
科目: 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A(g)+B(g)xC(g),符合图(I)所示关系,由此推断对图(II)的说法正确的是
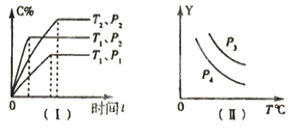
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示C的质量分数
C.P3>P4,Y轴表示混合气体密度
D.P3<P4,Y轴表示混合气体平均摩尔质量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向0.1molL-1CH3COOH 溶液中加入少量水,溶液中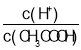 减小
减小
查看答案和解析>>
科目: 来源: 题型:
【题目】可用下面示意图表示的是
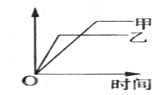
反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2molSO2和1molO2 | 2molSO2和2molO2 |
B | 2molSO2与1molO2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106Pa | 1×105Pa |
C | 相同质量氨,在同一固定容积容器中反应 | 氨气的浓度 | 400℃ | 500℃ |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定条件下,可逆反应:aA(g)+bB(g)![]() cC(g)+dD(g)达到平衡。
cC(g)+dD(g)达到平衡。
若其它条件不变,升高温度,则正反应速率________ (填“加快”或“减慢”,下同),逆反应速率________,重新达到平衡后c的质量增加,则正反应为_________(填“放热”或“吸热”)反应。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______(填化学式)。
(3)pH = 3的醋酸和pH = 11的氢氧化钠溶液等体积混合后溶液呈________(填“酸”、“中”、“碱”)性,溶液中c(Na+) ______c(CH3COO-) (填“>”、“=”、“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤烟气中含有大量NOx、CO2、CO和SO2,经处理可获得重要的化工原料。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=+1 160.0 kJ·mol-1
①反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH3=___________kJ·mol-1。
②若反应中还原NOx至N2,消耗标准状况下4.48L CH4,则反应过程中转移的电子总数为_____。
(2)利用烟气中分离所得的CO2、CO与H2按一定比例混合在催化剂的作用下合成甲醇,发生的主要反应如下:
反应1: CO(g)+2H2(g)=CH3OH(g)ΔH1=-99.0 kJ·mol-1
反应2: CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH2=+483.0 kJ·mol-1
反应3: CO2(g)+H2(g)=CO(g)+H2O(g)ΔH3=+384.0 kJ·mol-1
反应体系中CO平衡转化率(α)与温度和压强的关系如图所示。
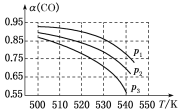
①α(CO)随温度升高而减小的原因是____________________。
②图中的p1、p2、p3由大到小的顺序为__________________。
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2在碱性环境中反应的离子方程式:________________。
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是:____________________。
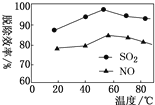
③从复合吸收剂吸收烟气后的废液中可回收得到NaHSO4,低温电解NaHSO4水溶液可制备工业上常用的强氧化剂Na2S2O8,原理如图所示。电解时电极Ⅰ的电极反应式为______________。
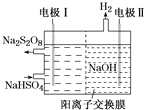
查看答案和解析>>
科目: 来源: 题型:
【题目】K2 FeO4在水中不稳定,发生反应:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
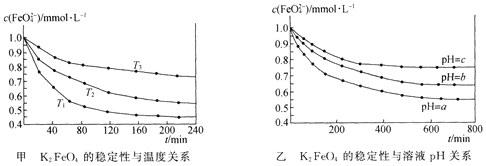
A.由图甲可知上述反应 △H < 0
B.由图甲可知温度:T1 > T2 > T3
C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱
D.由图乙可知图中a < c
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容密闭容器中,可逆反应![]() 达到平衡时的标志是(其中三种物质中只有
达到平衡时的标志是(其中三种物质中只有![]() 是有颜色的。)( )
是有颜色的。)( )
A.混合气体密度恒定不变B.混合气体的颜色不再改变
C.混合气体的压强不再变化D.三种气体的体积分数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。
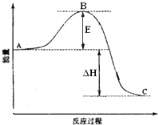
(已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ·mol-1。)请回答下列问题:
(1)图中A、C分别表示____、____,E的大小对该反应的反应热____(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“变大”、“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式____。
(4)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3molSO3(g)的ΔH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com