
科目: 来源: 题型:
【题目】下列有关装置图的叙述中正确的是

A. 用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液
B. 装置②的总反应式:Cu + 2Fe3+ = Cu2+ + 2Fe2+
C. 装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
D. 装置④中插入海水中的铁棒,越靠近底端腐蚀越严重
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应: ,但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350 K和470 K,经过足够长时间后,右端的主要物质是
,但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350 K和470 K,经过足够长时间后,右端的主要物质是

A. 纯Ni(s)和Ni(CO)4(g) B. 纯Ni(s)和CO(g)
C. 不纯Ni(s)和CO(g) D. 不纯Ni(s)和Ni(CO)4(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.某烃的同分异构体只能形成一种一氯代物,其分子式一定为C5H12
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.对二甲苯的核磁共振氢谱显示有3种不同化学环境的氢
查看答案和解析>>
科目: 来源: 题型:
【题目】邻硝基甲苯和对硝基甲苯能被用作爆炸品检测的示踪剂。某探究小组利用下图反应和装置制备一硝基甲苯。
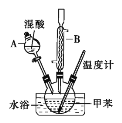
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:
①按体积比1∶3配制浓硫酸与浓硝酸的混合物80mL;②在250mL的三颈烧瓶中加入30mL(26g)甲苯,按图所示装好药品和其他仪器;③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);④控制温度约为50℃,反应大约10min,三颈烧瓶底有大量淡黄色油状液体出现;⑤分离出一硝基甲苯的总质量为27.20g。
请回答下列问题:
(1)使用仪器A前必须进行的操作是_______。
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、_______。
(3)配制混酸的方法是分别量取20mL浓硫酸和60mL浓硝酸,将浓_______倒入烧杯中,浓_______沿着烧杯内壁缓缓注入,并不断搅拌。
(4)控制温度约为50℃时,反应生成的产物一硝基甲苯是邻硝基甲苯和对硝基甲苯混合物,写出该反应生成对硝基甲苯的化学方程式_______。
(5)分离反应后产物的方案如下:

①操作1的名称为_______。
②操作2中,下列仪器选择及安装正确的是_______(填字母)。
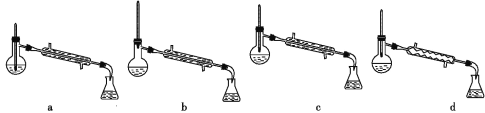
(6)该实验中一硝基甲苯的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下铁可以和 CO2 发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2 气体,反应过程中 CO2 气体和 CO 气体的浓度与时间的关系如图所示:

(1)t1 时,正、逆反应速率的大小关系为 v 正_____v 逆(填“>”“<”或“=”)。
(2)4 min 内,CO 的平均反应速率 v(CO)=_____。
(3)下列条件的改变能减慢其反应速率的是_____(填序号,下同)。
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是_____。
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2 的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是___________,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)__________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝和铁是中学化学常见的金属。请回答下列问题:
(1)常温下,铝和铁放入浓HNO3中会发生_______;
A.都反应产生氢气B.只有铝反应产生氢气
C.只有铁反应产生氢气D.都钝化
(2)常温下,铝粉和铁粉分别放入氢氧化钠溶液中,能反应产生氢气的是_______,
(3)铝热反应的化学方程式:2Al+Fe2O3![]() 2Fe+Al2O3,其氧化剂是_________。
2Fe+Al2O3,其氧化剂是_________。
A.AlB.FeC.Fe2O3D.Al2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)HCl、NH4Cl、CH3COOH和CH3COONa是中学常见的物质。
①常温下在pH=7的CH3COOH和CH3COONa的混合液中c(Na+)_______c(CH3COO-)(填“>”、“<”或“=”);
②常温下pH均为6的HCl和NH4Cl两种溶液中,设由水电离产生的H+浓度分别为amol/L和bmol/L,则a与b的关系是_______;
A.a=b B.a=100b C.b=100a
(2)T℃,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C物质的量变化如图所示。
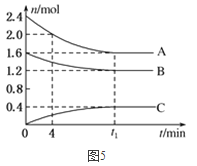
①T℃时,该反应的化学方程式为________;
②0~4分钟时,A的平均反应速率为_______molL-1min-1;
③达到平衡时B的转化率为________;
④T℃时,该反应的平衡常数为________。
(3)将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)ΔH=+140.5kJ/mol
C(s,石墨)+![]() O2(g)=CO(g) ΔH=-110.5kJ/mol
O2(g)=CO(g) ΔH=-110.5kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)的ΔH是_______。
A.+80.5kJ/mol B.+30.0kJ/mol
C.-30.0kJ/mol D.-80.5kJ/mol
(4)Cu(OH)2在水溶液中存在溶解平衡:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)c2(OH-)=2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,则产生沉淀,反之无沉淀。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH>________。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)c2(OH-)=2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,则产生沉淀,反之无沉淀。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH>________。
(5)茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。
①该电池中,海水是电解质溶液,负极材料_______(填“铝合金”或“Pt-Fe合金网”);
②该电池中负极电极反应式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)c(SO42﹣),所以在BaSO4溶液中有c(Ba2+)=c(SO42﹣)=![]()
③将0.1molL﹣1的NaHS和0.1molL﹣1Na2S溶液等体积混合,所得溶液中有c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S)
④在0.1mol/L氨水中滴加0.1mol/L盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10﹣a molL﹣1
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图所示。下列说法错误的是( )
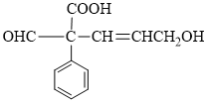
A.该有机物的分子式为C12H12O4
B.1 mol该有机物最多能与4 mol H2反应
C.该有机物可与NaHCO3溶液反应放出CO2,生成2.24 L CO2(标准状况下)需要0.1 mol该有机物
D.该有机物可发生氧化、取代、加成和还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com