
科目: 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的中心原子的杂化杂化类型为__。基态P原子核外电子占据最高能级的电子云轮廓图为__。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸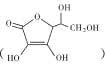 常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
(3)Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是___(填标号)。
A.![]() B.
B. C.
C.![]() D.
D.
查看答案和解析>>
科目: 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学进行如下实验![]() 溶液的浓度均为
溶液的浓度均为![]() 。
。
编号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 产生无色气泡 | 产生无色气泡液面上方呈浅红棕色 | 产生无色气泡 |
下列对实验现象的解释或推测不合理的是
A.![]() 中:
中:![]()
B.根据上述实验判断,![]() 的氧化性强于水
的氧化性强于水
C.![]() 中:
中:![]()
D.![]() 中使湿润pH试纸变蓝的气体是
中使湿润pH试纸变蓝的气体是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】图Ⅰ是实验室中常用于制备和干燥气体的装置:
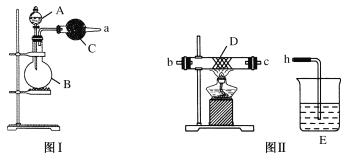
(1)甲同学用图Ⅰ装置、铜和稀硝酸制备并收集干燥的NO气体:
①B中反应的离子方程式为___;
②收集NO气体的方法为___。
(2)乙同学用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质:
往A中加入浓氨水,B中加入Na2O2固体,C中加入碱石灰,D内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器:
①实验中观察到D内有红棕色气体出现,证明氨气具有___(填“氧化性”或“还原性”)。
②D中反应的化学方程式为___、___。
③为防止NO2污染环境,E装置中装的试剂可以是___。
(3)丙同学用图1、铜和浓硫酸制取SO2,则需要增加___(填仪器名称)。实验中他们取6.4g铜片和3mL8mol/L浓硫酸放在圆底烧瓶,反应结束后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:___。实验中若有mg铜参加了反应,转移电子的数目为___。
②实验结束后发现铜片未完全溶解但硫酸剩余的原因是___。
③下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___(填字母)。
a.硫酸钠溶液 b.氯化钡溶液 c.银粉 d.碳酸氢钠固体
查看答案和解析>>
科目: 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A.4个B.3个C.2个D.1个
查看答案和解析>>
科目: 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Ni原子核外有__种运动状态不同的电子,M层的电子云有__种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Se的第一电离能低于As,原因是___。
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO2-中大π键应表示为__。
,则NO2-中大π键应表示为__。
(4)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(5)FeO是离子晶体,其晶格能可通过图中的Born—Haber循环计算得到。
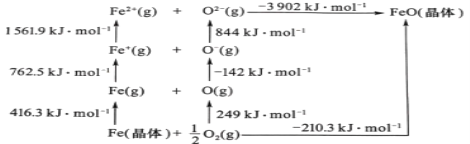
可知,O原子的第一电子亲和能为___kJmol-1,FeO晶格能为___kJmol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。
),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。

(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,FeS、CuS的溶度积常数分别为6.3×10-18 mol2·L-2、1.3×10-36 mol2·L-2。下列说法中,错误的是( )
A.25℃时,FeS的溶解度大于CuS的溶解度
B.反应CuSO4+H2S=CuS↓+H2SO4不能发生
C.可用FeS作沉淀剂除去废水中的Cu2+
D.25℃时,饱和CuS溶液中,Cu2+的浓度为![]() ×10-18 mol·L-1
×10-18 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
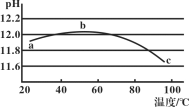
A.b点水解程度最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.水解是吸热过程
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )
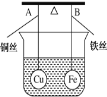
A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,CuSO4(s)和 CuSO4·5H2O(s)溶于水及CuSO4·5H2O受热分解的能量变化如图所示,下列说法不正确的是
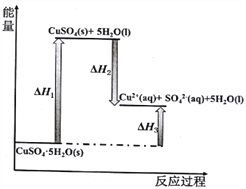
A. 将CuSO4·5H2O(s)溶于水会使溶液温度降低
B. 将CuSO4(s)溶于水会使溶液温度升高
C. △H3>△H2
D. △H1=△H2+△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com