
科目: 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A.一定条件下,1molFe与1molCl2充分反应,Fe失去的电子数目为3NA
B.在常温常压下,11.2L氯气含有分子数为0.5NA
C.7.8gNa2O2与水完全反应时,转移的电子数为0.1NA
D.1.2gNaHSO4晶体中所含离子数为0.03NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,![]() 与
与![]() 在多孔碳材料电极处生成
在多孔碳材料电极处生成![]() (
(![]() 或1)。下列说法正确的是
或1)。下列说法正确的是
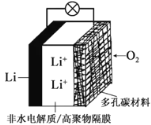
A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:![]()
查看答案和解析>>
科目: 来源: 题型:
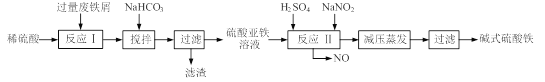
【题目】[2012·南通二调](12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在_____________________范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为_____________________________________________________________。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为_________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 2S2O32-+I2=2I-+S4O62-
则溶液中铁元素的总含量为_________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会_______ (填“偏高” “偏低” “不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】取Cu、Cu2O和CuO固体混合物,将其分成两等份,一份用足量的氢气还原,反应后固体质量减少6.40g,另一份加入1000mL稀硝酸,固体恰好完全溶解,收集到标准状况下NO气体4.48L,所用硝酸的物质的量浓度为
A. 3.2mol/L B. 1.6mol/L C. 0.9mol/L D. 无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目: 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)与时间(t)关系如右图。反应中镁和铝的
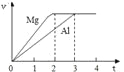
A. 物质的量之比为3:2 B. 质量之比为3:2
C. 摩尔质量之比为2:3 D. 反应速率之比为2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在恒温恒容密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
2NO+O2在恒温恒容密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的密度不再改变的状态
(6)混合气体的平均相对分子质量不再改变的状态
A.(1)(4)(6)B.(2)(3)(5)
C.(1)(3)(4)D.(1)(2)(3)(4)(5)(6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com