
科目: 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)将12.5g CuSO4·5H2O溶于水中形成1L溶液,溶质的物质的量浓度为_________mol·L-1
(2)氢原子的物质的量相等四种气体HCl、H2、NH3、CH4,在同温同压下,此四种气体体积之比V(HCl):V(H2):V(NH3):V(CH4)=______________。
(3)配制100mL 1.00 mol·L-1H2SO4溶液,需要用量筒量取浓硫酸(密度为1.84g·cm-3,溶质质量分数为98%)的体积为_____________mL。
(4)反应2K2S+ K2SO3+3H2SO4=3S↓+3 K2SO4+3H2O中,氧化剂与还原剂的物质的量之比为______,若反应生成0.6molS,则反应中转移的电子为____________mol。
(5)现有下列5种物质:①CO2 ②Mg ③盐酸 ④NaCl ⑤Na2CO3。上述物质属于电解质的有_____________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某 500 mL 溶液中只可能含有 Na+、NH4+、Mg2+、Al3+、Fe2+、Fe3+、Cl-、![]() 、
、![]() 中 的几种离子。
中 的几种离子。
已知:NH4++OH-=NH3↑ +H2O
(1)取该溶液l00 mL,逐滴加入足量的NaOH溶液并加热,生成标准状况下的气体体积为 896 mL(气体已全部逸出),滴加过程中无沉淀生成。则该溶液中一定不含有的阳离子是______.
(2)另取100 mL原溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀6.27 g,再加入足量稀盐酸,沉淀部分溶解,生成标准状况下的气体体积为448 mL。则原浓液中下列离子的浓度:
离子种类 | 离子浓度 |
| ①___molL-1 |
| ②___ molL-1 |
Na+ | ③__molL-1 |
写出加入盐酸时,生成气体的离子方程式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)Fe在元素周期表的位置为__,基态S原子电子占据最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
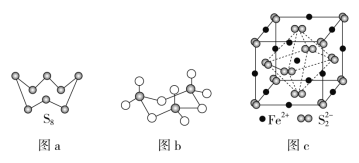
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有__种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为__。
(5)FeS2晶体的晶胞如图c所示。晶胞边长为apm、FeS2的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M的计算表达式为__g·mol-1;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为___pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() ,
,![]() 。
。![]() 时,向
时,向![]() 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.M点溶液中:![]()
B.![]() 的数量级为
的数量级为![]()
C.M点到N点: 的值不变
的值不变
D.N点:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A.酸性强弱:HX>HY>HZ
B.P点对应的溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
C.各溶液在滴定过程中任何时刻,溶液中水的电离一直受抑制
D.HZ的电离方程式为:HZ![]() H++Z-
H++Z-
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在①苯 ②苯酚 ③甲苯 ④氯乙烷 ⑤乙烯 ⑥乙醇中,(填编号)
<1>能和金属钠反应放出H2的有______ <2>能与NaOH溶液反应的有______
<3>常温下能与溴水反应的有_________ <4>能使酸性KMnO4溶液褪色的烃有_______
II.已知某有机物的结构简式为: ![]()
①该有机物中所含官能团的名称是________________________。
②该有机物发生加聚反应后,所得产物的结构简式为__________。
③写出该有机物发生消去反应的化学方程式(注明反应条件):_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】水杨酸冬青油、阿司匹林的结构简式如图,下列说法不正确的是

A. 由水杨酸制冬青油的反应是取代反应
B. 阿司匹林的分子式为C9H8O4,在一定条件下水解可得水杨酸
C. 冬青油苯环上的一氯取代物有4种
D. 可用NaOH溶液除去冬青油中少量的水杨酸
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,实验测得1.0 mol·L-1 NH4HCO3溶液的 pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在![]() 的水解平衡
的水解平衡
C. pH由8~11时, ![]() 不变
不变
D. pH=3时,有c(![]() )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.升高温度,水的离子积增大
B.![]() 气体受压缩后,气体颜色先加深,后略变浅
气体受压缩后,气体颜色先加深,后略变浅
C.![]() ,
,![]() ,HIg的平衡体系,压缩容器体积,气体色变深
,HIg的平衡体系,压缩容器体积,气体色变深
D.![]() 中加入
中加入![]() 溶液,溶液颜色变浅
溶液,溶液颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为__,δ、α两种晶胞中铁原子的配位数之比为__。
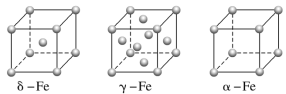
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__(填晶体类型)。
(3)铜晶体中铜原子的堆积方式为__,晶胞中原子的空间利用率为__。
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①如图表示的是___(填“CuCl2”或“CuCl”)的晶胞,其中Cl-的配位数为__。
②已知铜和Cl的电负性分别为1.9和3.0,则铜与Cl形成的化合物属于__(填“离子”或“共价”)化合物。
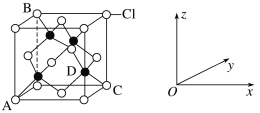
③原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com