
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
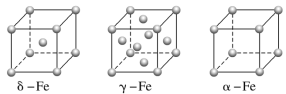
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为__,δ、α两种晶胞中铁原子的配位数之比为__。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__(填晶体类型)。
(3)铜晶体中铜原子的堆积方式为__,晶胞中原子的空间利用率为__。
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①如图表示的是___(填“CuCl2”或“CuCl”)的晶胞,其中Cl-的配位数为__。
②已知铜和Cl的电负性分别为1.9和3.0,则铜与Cl形成的化合物属于__(填“离子”或“共价”)化合物。
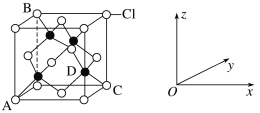
③原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为__。
【答案】4 4:3 分子晶体 面心立方最密堆积 74% CuCl 4 共价 (![]() ,
,![]() ,
,![]() )
)
【解析】
(1)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值;
(2)根据物质的熔沸点、溶解性等物理性质分析晶体类型;
(3)根据铜晶体中原子的堆积方式分析解答;
(4)运用分摊法根据晶胞结构及电负性概念分析解答。
(1)γ晶体晶胞中所含有的铁原子数为![]() ,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,故答案为:4; 4:3;
,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,故答案为:4; 4:3;
(2)配合物Fe(CO)x的熔沸点比较低,易溶于非极性溶剂,应属于分子晶体,故答案为:分子晶体;
(3)铜晶体中铜原子的堆积方式如图所示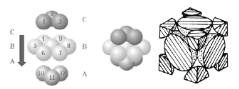 ,属于面心立方最密堆积,晶胞中原子的空间利用率为74%,故答案为:面心立方最密堆积;74%;
,属于面心立方最密堆积,晶胞中原子的空间利用率为74%,故答案为:面心立方最密堆积;74%;
(4)①白色球为Cl原子,黑色球为Cu原子,晶胞中Cu原子为4,Cl原子数目为![]() ,则图示晶胞表示CuCl ;图示结构中Cu的配位数为4,且离子数目比为1:1,则Cl-的配位数为4,故答案为: CuCl;4;
,则图示晶胞表示CuCl ;图示结构中Cu的配位数为4,且离子数目比为1:1,则Cl-的配位数为4,故答案为: CuCl;4;
②已知铜和Cl的电负性分别为1.9和3.0,3.0-1.9=1.1<1.7,则Cu和Cl形成的化合物为共价化合物,故答案为:共价;
③原子坐标参数表示晶胞内部各原子的相对位置,图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);D与C的连线处于晶胞体对角线上,且DC长度等于体对角线长度的![]() ,D在底面投影D′处于面对角线AC上,且AD′长度等于D′C长度的三倍,则D到底面(即坐标系xoy面)的距离等于晶胞棱长的
,D在底面投影D′处于面对角线AC上,且AD′长度等于D′C长度的三倍,则D到底面(即坐标系xoy面)的距离等于晶胞棱长的![]() ,即参数z=
,即参数z=![]() ,D到左侧平面(即坐标系yoz面)的距离等于晶胞棱长的
,D到左侧平面(即坐标系yoz面)的距离等于晶胞棱长的![]() ,即参数x=
,即参数x=![]() ,D到前平面(即坐标系xoz面)的距离等于晶胞棱长的
,D到前平面(即坐标系xoz面)的距离等于晶胞棱长的![]() ,即参数y=
,即参数y=![]() ,故D的坐标参数为:(
,故D的坐标参数为:(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() )。
)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中和滴定的误差要求小于0.1%,若用20.00 mL0.2000mol·L-1盐酸滴定20mL0.2000mol·L-1NaOH溶液,则中和滴定曲线中发生突变时的pH范围是(lg2=0.3)( )
A. 4.3~9.7B. 3.7~10.3C. 4.0~10.0D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
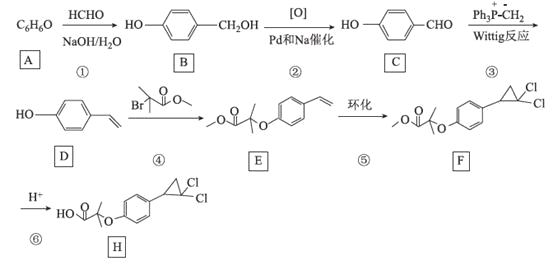
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,以煤为原料制备的一些化工产品前景又被看好。下图是以烃A为原料生产人造羊毛的合成路线。下列说法正确的是
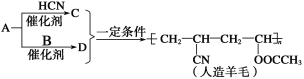
A.A生成C的反应属于加成反应B.合成人造羊毛的反应属于缩聚反应
C.A生成D的反应属于取代反应D.烃A的结构简式为CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应I的化学方程式为2C+SiO2![]() Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2![]() Si+CO2↑(碳不足)和__________________________________(碳足量)。
Si+CO2↑(碳不足)和__________________________________(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
图中“操作X”的名称为______________________;PCl3的电子式为________________。
(3)反应IV的化学方程式为SiCl4+4NH3![]() Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A.酸性强弱:HX>HY>HZ
B.P点对应的溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
C.各溶液在滴定过程中任何时刻,溶液中水的电离一直受抑制
D.HZ的电离方程式为:HZ![]() H++Z-
H++Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据:
苯 | 溴 | 溴苯 | |
密度/g·cm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
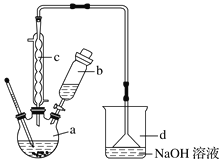
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体,继续滴加液溴滴完。铁屑的作用是___________;a中发生的化学反应方程式______________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏D.萃取
(4)在该实验中,a的容积最适合的是_______(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别是__、__(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)r(Li+)__r(H-),原因是___。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是__。中心原子的杂化形式为___。LiAlH4中,存在__(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图a的BornHaber循环计算得到。
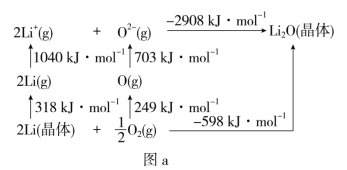
可知,Li原子的第一电离能为__kJ·mol-1,O=O键键能为__kJ·mol-1,Li2O晶格能为__kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图b所示,已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为___g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为综合利用高浓度磷复肥工业的副产品磷石膏![]() 主要成分为
主要成分为![]() ,进行的研究如下:
,进行的研究如下:
![]() 一定条件下,
一定条件下,![]() 的脱水反应相关的热化学方程式如下:
的脱水反应相关的热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
则该条件下反应![]() 的
的![]() ________
________![]() 。
。
![]() 作还原剂与磷石膏的反应为
作还原剂与磷石膏的反应为![]()
![]() 。向盛有
。向盛有![]() 的
的![]() 真空恒容密闭容器中充入
真空恒容密闭容器中充入![]() ,反应体系起始总压强为
,反应体系起始总压强为![]() ,在
,在![]() 下,固体物质的物质的量随时间变化的关系如图1所示。
下,固体物质的物质的量随时间变化的关系如图1所示。
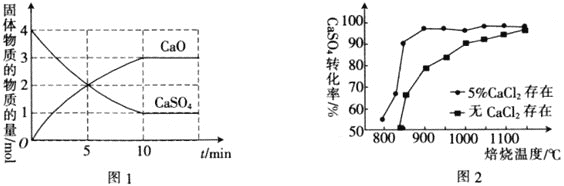
![]() 内,
内,![]() ________。
________。
![]() 达到平衡时,CO的转化率为________。
达到平衡时,CO的转化率为________。
![]() 该反应的压强平衡常数
该反应的压强平衡常数![]() ________
________![]() 用含a的代数式表示;用平衡分压代替平衡浓度计算,分压
用含a的代数式表示;用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 以高硫煤为还原剂焙烧磷石膏,可将
以高硫煤为还原剂焙烧磷石膏,可将![]() 还原,得到的
还原,得到的![]() 可用于工业生产硫酸。图2为熔烧
可用于工业生产硫酸。图2为熔烧![]() 小时内
小时内![]() 对硫酸钙转化率的影响图像,焙烧温度达到
对硫酸钙转化率的影响图像,焙烧温度达到![]() 之前,使用
之前,使用![]() 可以________
可以________![]() 填“提高”“降低”或“不影响”
填“提高”“降低”或“不影响”![]() 的转化率。
的转化率。
![]() 利用反应
利用反应![]() 可将磷石膏转化为硫酸铵。
可将磷石膏转化为硫酸铵。
![]() 已知:氨水
已知:氨水![]() ,碳酸
,碳酸![]() ,
,![]() 。则
。则![]() 溶液显________
溶液显________![]() 填“酸性”“碱性”或“中性”
填“酸性”“碱性”或“中性”![]() 。
。
![]() 的
的![]() 溶液显酸性的原因是________
溶液显酸性的原因是________![]() 用离子方程式表示
用离子方程式表示![]() ,溶液中
,溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com