
科目: 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO![]() +2HClO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO![]() ═SO
═SO![]() +2HCO
+2HCO![]()
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO![]() ═CO2↑+H2O
═CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关能量的判断或表示方法正确的是
A.相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
B.从C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知相同条件下金刚石比石墨更稳定
C.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,可知:含1 molCH3COOH的稀溶液与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2 H2O(l) △H=-285.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在体积为2L的恒容密闭容器中,某一反应中![]() 、
、![]() 、
、![]() 三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
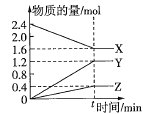
A.反应的化学方程式为![]()
B.t时刻,正、逆反应都不再继续进行,反应达到化学平衡
C.若![]() ,则0~tmin内
,则0~tmin内![]() 的化学反应速率为
的化学反应速率为![]()
D.温度、体积不变,在tmin时充入![]()
![]() 使压强增大,正、逆反应速率都增大
使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A. c1:c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0 mol/L<c1 <0.14 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某地以高硫铝土矿![]() 主要含Al2O3、Fe2O3、SiO2和少量的FeS2等
主要含Al2O3、Fe2O3、SiO2和少量的FeS2等![]() 提取氧化铝和磁性氧化铁,直接碱溶法往往形成铝硅酸钠沉淀[NamAlmSinO16(OH)5]而造成铝损失。一种改进后的流程如下:
提取氧化铝和磁性氧化铁,直接碱溶法往往形成铝硅酸钠沉淀[NamAlmSinO16(OH)5]而造成铝损失。一种改进后的流程如下:
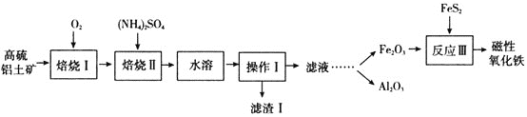
⑴铁在元素周期表中的位置是________________;NamAlmSinO16(OH)5中的m和n之间满足什么样的代数式________;写出滤渣Ⅰ主要成分的一种用途:________________________;反应Ⅲ加入FeS2的目的是作为________________________![]() 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂”![]() 。
。
⑵焙烧Ⅰ过程中会产生大量红棕色烟尘和SO2气体,写出产生这一现象的化学方程式:________________________________________________。
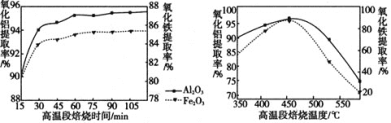
⑶焙烧Ⅱ由氧化铝、氧化铁制得可溶性的NH4Al(SO4)2、NH4Fe(SO4)2。提取率随温度、时间变化曲线如图所示,最佳的焙烧时间与温度是________________。若以NH4R(SO4)2表示NH4Al(SO4)2、NH4Fe(SO4)2,相关的化学反应方程式为________________________。
⑷下列有关铝硅酸钠[NamAlmSinO16(OH)5]中所含元素性质的说法正确的是________。
A.因为原子半径:Na > S,所以离子半径:Na+ > S2-
B.因为非金属性:S > Si,所以简单气态氢化物稳定性:SiH4 < H2S
C.因为非金属性:O > S,所以沸点; H2S > H2O
D.因为金属性:Na > Al,所以碱性:NaOH > Al(OH)3
⑸为了测定Wg高硫铝土矿中铝元素的含量,将流程中制取的Al2O3溶解于足量稀硫酸,配成250mL溶液,取出25mL,加入c mol·L-1 EDTA标准溶液amL,调节溶液pH约为4.2,煮沸,冷却后用b mol·L-1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1:1)。则Wg高硫铝土矿中铝元素的质量分数为________________________![]() 用含V、W、a、b、c的代数式表示
用含V、W、a、b、c的代数式表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中充入![]() 和
和![]() ,压强为
,压强为![]() ,并在一定温度下使其发生反应
,并在一定温度下使其发生反应![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.保持容器容积不变,向其中加入![]() ,化学反应速率不变
,化学反应速率不变
B.保持容器容积不变,向其中加入1molAr,化学反应速率增大
C.保持容器内压强不变,向其中加入1molAr,化学反应速率不变
D.保持容器内压强不变,向其中加入![]() ,化学反应速率将发生变化
,化学反应速率将发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
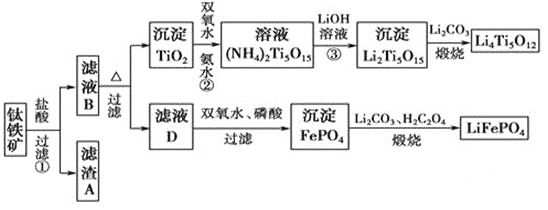
⑴钛铁矿在预处理时需要进行粉碎,其原因是__________________________________。
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________________________。
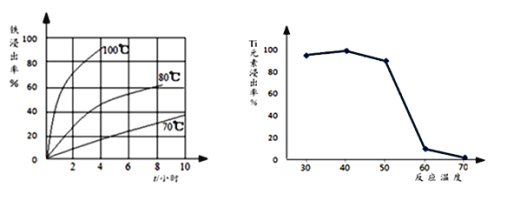
⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是_______________________。
⑷写出由滤液D生成FePO4的离子方程式_____________________________________________
⑸由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】减排是各个国家都在努力为之的事,![]() 和
和![]() 的处理是许多科学家都在着力研究的重点。有学者想以如图所示装置利用原电池原理将
的处理是许多科学家都在着力研究的重点。有学者想以如图所示装置利用原电池原理将![]() 、
、![]() 转化为重要的化工原料。
转化为重要的化工原料。
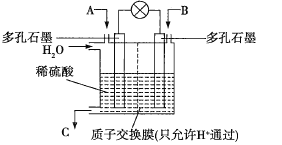
(1)若A为![]() ,B为
,B为![]() ,C为
,C为![]() ,电池总反应方程式为
,电池总反应方程式为![]() ,则正极的电极反应式为________。
,则正极的电极反应式为________。
(2)若A为![]() ,B为
,B为![]() ,C为
,C为![]() ,则负极的电极反应式为_________,电池的总反应方程式为___________。
,则负极的电极反应式为_________,电池的总反应方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com