
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:![]() 在恒温恒容密闭容器中反应,达到平衡状态的标志是
在恒温恒容密闭容器中反应,达到平衡状态的标志是
![]() 单位时间内生成n
单位时间内生成n![]() 的同时消耗2n
的同时消耗2n![]() ;
;
![]() 单位时间内生成n
单位时间内生成n![]() 的同时消耗2nmolNO;
的同时消耗2nmolNO;
![]() 混合气体的颜色不再改变的状态;
混合气体的颜色不再改变的状态;
![]() 混合气体中
混合气体中![]() 不变;
不变;
![]() 的消耗速率与NO的生成速率相等;
的消耗速率与NO的生成速率相等;
![]() 容器内压强不随时间变化而变化。
容器内压强不随时间变化而变化。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】等质量且足量的两份锌a、b,分别加入等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列各图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
A. 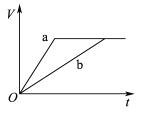 B.
B. 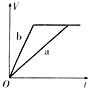
C. 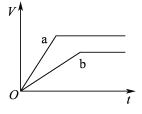 D.
D. 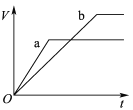
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是
A. 已知![]()
![]() ,则氢气的燃烧热为-241.8kJ/mol
,则氢气的燃烧热为-241.8kJ/mol
B. ![]() 、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的
、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的![]() 和
和![]()
C. 含![]() 的稀溶液与稀硫酸完全中和,放出
的稀溶液与稀硫酸完全中和,放出![]() 的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)
的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ![]()
D. 已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
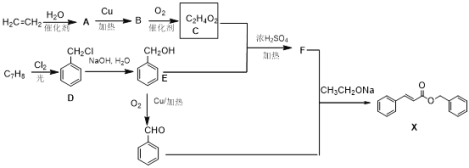
已知:RCOOH+R′OH![]() RCOOR′+H2O
RCOOR′+H2O
(1)A的化学名称______________,X中含有的官能团名称_______;
(2)X的分子式_______________,F的结构简式_______________;
(3)乙烯到A的反应类型___________,由A 生成B的化学方程式_________,C和E反应生成F的化学方程式__________;
(4)除D外,D的同分异构体芳香族化合物有(不考虑立体异构)______种,其中核磁共振有三组峰,且峰面积之比为3:2:2的结构式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取9.0g A,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:_____。 |
(2)将此9.0g A在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______。 |
(3)另取9.0g A,跟足量的碳酸氢钠粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
(4)A的核磁共振氢谱如图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式__________。 | |
查看答案和解析>>
科目: 来源: 题型:
【题目】在四个不同容器中,不同条件下进行反应N2+3H22NH3,根据在相同时间内测定的结果,判断该反应的速率最大的是( )
A. υ(NH3)=0.5molL﹣1min﹣1
B. υ(H2)=0.3molL﹣1min﹣1
C. υ(N2)=0.2molL﹣1min﹣1
D. υ(H2)=0.01molL﹣1s﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体形、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
Q | I1 | I2 | I3 | I4 | I5 | … |
电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
回答下列有关问题:
(1)W原子的外围电子排布图为____________。
(2)化合物XYZ的结构式是______。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是__________(写分子式),原因是_________。
(4)RW3分子中的键角_______,RW32-的立体构型是_________形。
查看答案和解析>>
科目: 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。

pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com