
科目: 来源: 题型:
【题目】下列说法正确的是
A.一定温度下,10mL 0.50mol·L-1 NH4Cl溶液与20mL 0.25mol·L-1 NH4C1溶液含NH4+物质的量相同
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3·H2O的电离常数![]()
C.一定温度下,已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中![]() 值增大。
值增大。
D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下两种不同浓度的NaOH溶液,c(H+)分别为1×10-13 mol/L和1×10-10 mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A.1×(10-14+10-10) mol/LB.![]() mol/L
mol/L
C.2×10-13 mol/LD.2×10-14 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于常温下电解质溶液的叙述中,正确的是( )
A.向![]()
![]() 溶液中加入等体积
溶液中加入等体积![]() NaOH溶液,测得溶液中
NaOH溶液,测得溶液中![]() ,则水的电离程度比纯水的大
,则水的电离程度比纯水的大
B.![]() 时,
时,![]() 的
的![]() 溶液中由水电离出的
溶液中由水电离出的![]()
C.等物质的量浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 前者小于后者
前者小于后者
D.等物质的量浓度、等体积的氨水和盐酸混合后,![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如下。
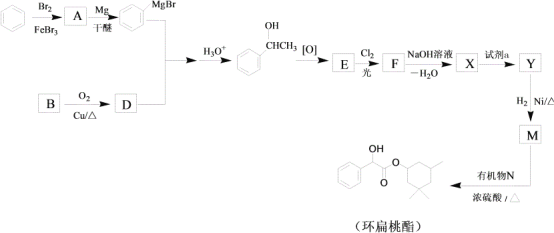
已知:RX ![]() R-MgX
R-MgX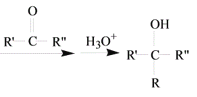 (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
(1)A 的结构简式是___________________
(2)B → D 的化学方程式是________________
(3)红外吸收光谱表明 E 有 C=O 键。 F 的分子式为 C8H6Cl2O 。
①E 的结构简式是________
②E → F 的反应类型是________
(4)X 的结构简式是________
(5)试剂 a 是________
(6)生成环扁桃酯的化学方程式是________
(7)以 CH3CH=CH 2 、 CH3CHO 为有机原料, 结合题目所给信息 ,选用必要的无机试剂合成 CH2=CHCH=CHCH3,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
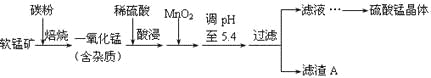
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.Penguinone分子 所有碳原子不可能都在同一个平面上
所有碳原子不可能都在同一个平面上
B.1mol 分别与足量的Na、NaOH溶液、
分别与足量的Na、NaOH溶液、![]() 溶液反应,消耗这三种物质的物质的量分别为5mol、3mol、1mol
溶液反应,消耗这三种物质的物质的量分别为5mol、3mol、1mol
C.醋酸和软脂酸互为同系物,![]() 和
和![]() 也一定互为同系物
也一定互为同系物
D.蛋白质遇到醋酸铅生成沉淀,加入大量的水,沉淀还可溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
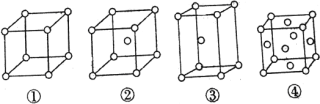
A. ①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为①1个②2个③4个④4个
C. 晶胞中原子的配位数分别为①6 ②8 ③12 ④12
D. 空间利用率的大小关系为①<②<③<④
查看答案和解析>>
科目: 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为![]() 制备原料为
制备原料为![]() 、
、![]() 和
和![]() ,电解液为
,电解液为![]() 的碳酸丙烯酯溶液。
的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态Na原子中,核外电子占据的原子轨道总数为______。
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为______![]() 用元素符号表示
用元素符号表示![]() 。
。
(4)碳酸丙烯酯的结构简式如下图所示,则其中碳原子的杂化轨道类型为______,1mol碳酸丙烯酯中σ键的数目为______。
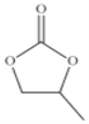
![]() 的几何构型为正八面体形,配体是______,该配离子包含的作用力为______
的几何构型为正八面体形,配体是______,该配离子包含的作用力为______![]() 填选项字母
填选项字母![]() 。
。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如下图所示,该晶胞的密度为ρg/![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则Na与O之间的最短距离为_______________________
,则Na与O之间的最短距离为_______________________ ![]() 用含ρ、
用含ρ、![]() 的代数式表示
的代数式表示![]() 。
。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com