
科目: 来源: 题型:
【题目】用块状碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
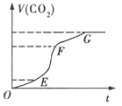
(1)实验过程如图所示,分析判断:(填“OE”、“EF”或“FG”,下同)___段化学反应速率最大,___段收集的二氧化碳气体最多。
(2)ag块状碳酸钙与足量盐酸反应,碳酸钙消耗的质量随时间的变化曲线用实线表示,在相同的条件下,将bg(a>b)粉末状碳酸钙与足量的相同浓度的盐酸反应,碳酸钙消耗的质量随时间的变化曲线用虚线表示。则图中最符合实际情况的图象是___(填序号)。
A.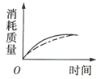 B.
B.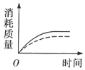 C.
C. D.
D.
(3)为了减缓题述反应的速率,下列措施中,你认为可行的是___(填序号)
A.加入蒸馏水
B.加入氯化钠固体
C.加入硝酸钾溶液
D.加入浓盐酸
E.降温
F.加入MnO2粉末
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质未列出。已知:A、C、D、F均为单质,C、E、F、G常温下是气体,J为白色沉淀,既能溶于B,又能溶于E;物质B、G可以使湿润的红色石蕊试纸变蓝,且B的焰色反应反应呈黄色。反应![]() 是化肥工业的重要反应。
是化肥工业的重要反应。
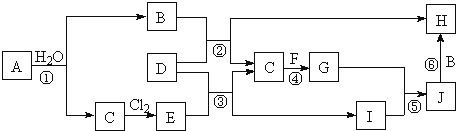
请回答下列问题:
(1)![]() 的元素在元素周期表中的位置是______,物质B的电子式为______。
的元素在元素周期表中的位置是______,物质B的电子式为______。
(2)上述反应![]() 中,属于化合反应的是______,反应
中,属于化合反应的是______,反应![]() 的离子方程式为______。
的离子方程式为______。
(3)在I的水溶液滴加B溶液至过量的过程中,所观察到的现象为______。
(4)已知G能与![]() 发生置换反应。若以该反应为原理,用石墨作电极构成原电池,负极的电极反应式是______。
发生置换反应。若以该反应为原理,用石墨作电极构成原电池,负极的电极反应式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K2
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=__(用K1、K2表示)。
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示:
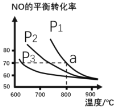
①对于气相反应,用某组分(B)的平衡分压强p(B)代替物质的量浓度c(B)也可表示平衡常数kp,如果p1=1.65MPa,求a点的平衡常数kp=__(MPa)1(结果保留3位有效数字,分压=总压×物质的量分数)。
②为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了2条速率—浓度关系曲线:v正~c(NO)和v逆~c(CO2)则:与曲线v正~c(NO)相对应的是图中曲线__(填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,v正和v逆相应的平衡点分别为___(填字母)。
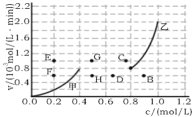
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72的废水,如图所示;电解过程中溶液发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O。甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为___。
(4)已知H3PO4为三元酸,Ka1=7.0×103mol·L1,Ka2=6.2×108mol·L1,Ka3=4.5×1013mol·L1。则Na2HPO4水溶液呈__。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国谚语与古籍中,有许多关于化学变化的记载。例如,谚语“雷雨发庄稼”;《淮南万毕术》中记载“曾青得铁则化为铜”,以上例子不涉及的反应是( )
A.N2+O2![]() 2NOB.Zn+Fe2+=Zn2++Fe
2NOB.Zn+Fe2+=Zn2++Fe
C.Fe+Cu2+=Fe2++CuD.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目: 来源: 题型:
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度
查看答案和解析>>
科目: 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
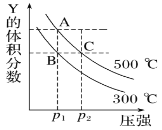
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目: 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严重。将燃料电池引入硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如图所示。
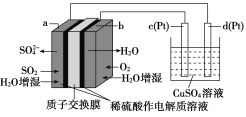
下列说法不正确的是( )
A.b为正极,电极反应式为O2+4H++4e-===2H2O
B.H+由a极通过质子交换膜向b极移动
C.该燃料电池的总反应为2SO2+O2+2H2O===2H2SO4
D.若a电极消耗标况下2.24 L SO2,理论上在c极上有6.4 g铜析出
查看答案和解析>>
科目: 来源: 题型:
【题目】有关![]() 反应的叙述正确的为
反应的叙述正确的为
A.还原剂与氧化剂物质的量之比为5:3
B.生成lmolO2,反应共转移4mol电子
C.若有5mol水做还原剂时,被BrF3还原的BrF3为![]() mol
mol
D.若有5mol水参与反应时,被水还原的BrF3为2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )
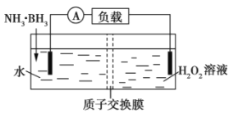
A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:Cr2O72-(aq) + H2O(l)![]() 2CrO42- (aq) +2H+(aq)
2CrO42- (aq) +2H+(aq)
(1)写出上述反应的平衡常数表达式:K=_______________________。
(2)向重铬酸钾中加入少量NaOH固体,溶液呈_________色。
(3)向(2)所得的溶液中加入过量的稀硫酸,则溶液呈________色,因为_______________。
(4)向原溶液中加入Ba(NO3)2溶液(BaCrO4为难溶性黄色沉淀),则平衡_________(填“正向移动”、“逆向移动”或“不移动”),溶液颜色将_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com