
科目: 来源: 题型:
【题目】第ⅢA族硼、稼及其化合物在材料科学领域有广泛应用。
(1)基态硼原子电子排布图为___。
(2)常温下,Ga(CH3)3呈液态。在高温条件下,Ga(CH3)3和AsH3反应可制备半导体材料GaAs和另一产物为M,
①M是__分子(填“极性”或“非极性”);Ga(CH3)3中Ga原子和C原子构成的空间构型是__。
②Ga(CH3)3的晶体类型是__晶体;B、Ga和As均属于__区元素(填字母)。
A.s B.p C.d D.ds
(3)硼酸(H3BO3)是层状结构晶体(如图甲所示),在冷水中溶解度很小,加热时溶解度增大。
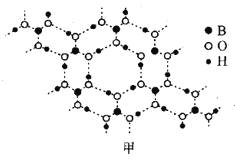
①硼酸晶体中存在的作用力有__(填字母)。
a.σ键极 b.π键 c.氢键 d.范德华力
②硼酸在水中溶解度随着温度升高而增大的主要原因可能是__。
(4)NaBH4、LiBH4常作有机合成的还原剂,其中B原子的杂化轨道类型是__。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞如图乙所示。已知:P-B键键长为Rnm,NA是阿伏加德罗常数的值。
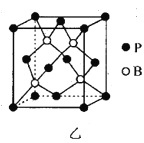
①该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为___nm。
②BP晶体密度为__g·cm-3(用含R和NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
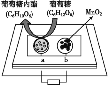
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对反应热的描述中,正确的是( )
A. 甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.3 kJ·mol-1
B. 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H =-2a kJ·mol-1
2NH3(g) △H =-2a kJ·mol-1
C. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l) =2H2(g)+O2(g) △H =+571.6 kJ·mol-1
D. HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量为57.3kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】已知海水中的溴含量约为65 mg/L,从海水中提取溴的工业流程如下:
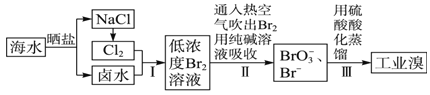
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____________(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
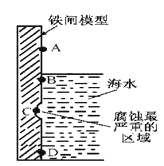
①该电化腐蚀称为__________________。
②图中A、B、C、D四个区域,生成铁锈最多的是_________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
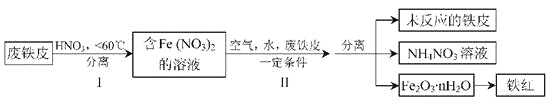
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为____________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为________________________。
③上述生产流程中,能体现“绿色化学”思想的是____________________(任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=_____________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。

回答下列问题:
(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_________________。氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________________。操作Ⅰ的名称为_________。
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
(5)298K时,向c(Ce3+)=0.02mol·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?__________________{列式计算,已知:Ksp[Ce(OH)3]5×l0-20,c(Ce3+)-5mol·L-1 视为沉淀完全}。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol·L-1 H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.若0.1 mol·L-1 NaHA溶液中c(H+)=0.02 mol·L-1,则0.1 mol·L-1的H2A中c(H+)<0.12 mol·L-1
D.在0.1 mol·L-1的H2A溶液中,c(H+)=0.12 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物有如下转化关系:
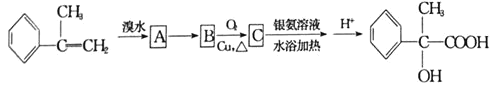
(1)写出反应![]() 的反应条件是________,C中官能团的结构简式是________________。
的反应条件是________,C中官能团的结构简式是________________。
(2)反应![]() 的反应类型为________________________。
的反应类型为________________________。
(3)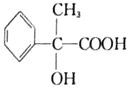 在浓硫酸加热条件下可以生成含有三个六元环结构的环酯,该有机物结构简式为:________________。
在浓硫酸加热条件下可以生成含有三个六元环结构的环酯,该有机物结构简式为:________________。
(4)任意写出一种符合下列条件的C的同分异构体的结构简式:________________。
①属于芳香族化合物,苯环上有两个取代基
②与碳酸氢钠溶液反应放出二氧化碳气体
③苯环上的一氯代物有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com