
科目: 来源: 题型:
【题目】ⅰ.有下列物质:①铜;②硫酸钡固体;③氨水;④氢氧化钠固体;⑤熔融硝酸钾;⑥乙醇;⑦盐酸;⑧金刚石;⑨二氧化硫;⑩冰醋酸。
其中能导电的有_______;(填序号,下同)属于非电解质的有_____;属于强电解质的有_____;
ⅱ.写出①H2SO3 ②CH3COONH4在水中的电离方程式:
___________________________________________________________;
___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如下图。则下列判断错误的是
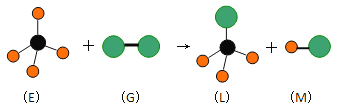
A. 常温常压下,E是一种无色无味的气体
B. 上述反应类型是加成反应
C. 在光照条件L能与 G继续发生与上述类似的反应
D. 上述反应类型是取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的p能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的外围电子排布图为__,其基态原子有__种能量不同的电子。
(2)R的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是__。
(3)ZM3-空间构型为___,其中Z的杂化方式为__。
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为___;与YM分子互为等电子体的离子的化学式为___。
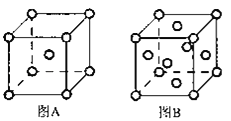
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:图B中原子堆积方式为___,A、B中W原子的配位数之比为___。A、B晶胞的棱长分别为acm和bcm,则A、B两种晶体的密度之比为___。
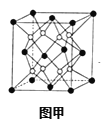
(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g) ![]() N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为________、电子数为___________。
(2)硅主要以硅酸盐、___________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________相结合,其晶胞中共有8个原子,其中在面心位置贡献__________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为_________,化学式为__________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
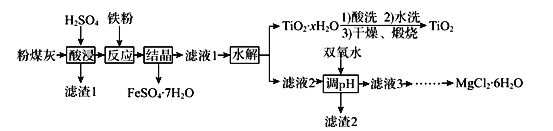
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________
(2)“水解”反应的离子方程式为______________________________________。怎样判断TiO2xH2O沉淀已经洗涤干净____________________________________________。
(3)加入双氧水调节溶液pH时离子方程式为_______________________________________。滤渣2成分为________________。为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”为________。(保留两位有效数字)
(4)滤液3在蒸发结晶制备MgCl26H2O应注意_____________________________________。
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol):
2NH3(g) △H=-92.4kJ/mol):
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 1molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是( )
A.![]() >c3B.a + b=92.4C.P2>2P3D.α1 +α3>1
>c3B.a + b=92.4C.P2>2P3D.α1 +α3>1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是有关苯的性质及反应条件的物质转化关系图,请根据图示内容回答有关问题:
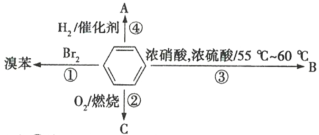
(1)反应②产生较多的黑烟,原因是____________。
(2)反应③的化学方程式是______________。
(3)反应④中生成物的分子式是__________。
(4)图示四个反应中,属于加成反应的是____(填序号,下同),属于取代反应的是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.在CH3COOH分子中的所有碳原子和氧原子都在同一平面
B.在 中单体为
中单体为![]() 和NC-CHO
和NC-CHO
C.1mol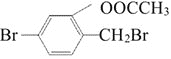 与NaOH溶液完全反应,消耗NaOH5mol
与NaOH溶液完全反应,消耗NaOH5mol
D.![]() 与Br21︰1加成可有4种加成产物
与Br21︰1加成可有4种加成产物
查看答案和解析>>
科目: 来源: 题型:
【题目】科学的进步离不开技术的突破。原子光谱、核磁共振、X射线衍射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构研究等。
(1)过渡元素Ni原子的基态电子排布式为____________________,Ni的核外电子由基态跃迁至激发态时产生的光谱是__________(填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+]可以与甲基磺酸根(CH3SO3-)形成超分子晶体,其局部结构如图所示。
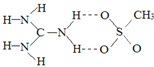
①组成该晶体的元素中第一电离能最大的是_____________,其中C的杂化类型有_______________。
②元素C、N、S的简单氢化物在水中的溶解度从大到小的顺序为__________,原因是__________。
(3)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线衍射分析其晶胞结构如图所示。
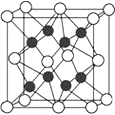
①晶胞中Na堆积形成__________(填形状)空隙,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是_________________________。
②已知晶胞边长为a nm,晶胞中Na的半径为b nm,则He的半径为__________nm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com