
科目: 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )


图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是从复合花序植物黄花蒿中提取得到的一种有效的疟疾治疗药物。查阅资料知:常温下,青蒿素为无色针状晶体,味道较苦,难溶于水,易溶于有机溶剂,熔点为![]() ;从青蒿中提取青蒿素的方法主要有乙醚浸提法和溶剂汽油浸提法。
;从青蒿中提取青蒿素的方法主要有乙醚浸提法和溶剂汽油浸提法。
回答下列问题:
(一)用乙醚浸提法提取青蒿素的流程如下图:

(1)对青蒿进行破碎的目的是______。
(2)操作Ⅰ所用到的玻璃仪器是______,操作Ⅱ的仪器选择及安装都正确的是______(填标号)。
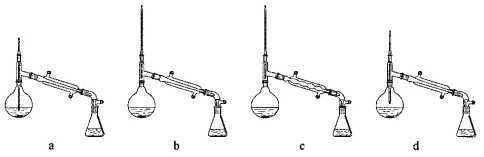
(3)操作Ⅲ的主要过程可能是______。
a.加水溶解,蒸发浓缩、冷却结晶
b.加95%乙醇,浓缩、结晶、过滤
c.加入乙醚进行萃取分液
(二)青蒿素分子式的测定
用如图所示的实验装置测定青蒿素的分子式,将28.2 g青蒿素放在燃烧管C中充分燃烧:
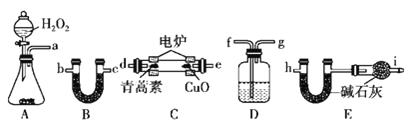
(4)①仪器各接口的连接顺序从左到右依次为______![]() 每个装置限用一次
每个装置限用一次![]() ;
;
②装置E中干燥管的作用是______;
③装置D中的试剂为______;
④已知青蒿素分子中只含碳、氢、氧三种元素,用合理连接后的装置进行实验,测量数据如表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素分子中碳、氢、氧三种原子的个数比为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应:2NO(g) + O2(g)![]() 2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
A.①②③B.②③④C.③④⑤D.①②⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙 中电解质溶液含溶质均为 1 mol。将电源接通后,向乙中滴入酚酞溶液,在 F 极附近显红色。
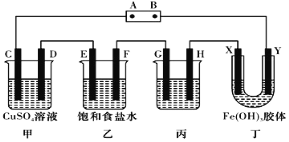
试回答下列问题:
(1)电源 A 极的名称是 ________。
(2)当电路中通过 4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入__________(填某一种物质的化学式和物质的量)。
(3)乙装置中电解反应的总化学方程式为 __________________ 。
(4)若要在丙装置中实现铁器上镀银,银在 _____(填 G 或 H)级。
(5)装置丁中的现象是 _________________________。
(6)若电源用碱性氢氧燃料电池代替,则该电池正极的电极反应式为 ______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)赤水晒醋是我们遵义特产之一,其中含有一定量的CH3COOH。写出CH3COOH的电离方程式 ______;在已达平衡的乙酸溶液中加入一定的CH3COONa ,该溶液pH_______(填“增大”“减小”或“不变”)。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是___________;负极反应是____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是__________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是___________。
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s) ![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是_____(填写序号);其中②中氯离子的浓度为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图所示装置制取少量溴苯。下列说法不正确的是![]()
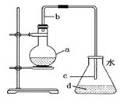
A.在烧瓶a中装的试剂是苯、液溴和铁屑
B.导管b的作用是导气和冷凝回流
C.反应过程中在导管c的下口附近可以观察到白雾出现
D.反应完毕后,向锥形瓶d中滴入![]() 溶液,有淡黄色沉淀生成
溶液,有淡黄色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。
已知:2Na2CO3+3H2O2=2Na2CO3·3H2O △H<0;回答下列问题:
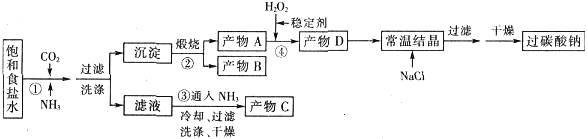
(1)下列物质可使过碳酸钠较快失效的是(填序号)_________。
A.FeCl3溶液 B.H2S C.稀硫酸 D.NaHCO3溶液
(2)反应①应先通入的气体是__________。写出反应①的化学方程式 (写总反应)
(3)加入NaCl的作用是 。
(4)该生产流程中可循环使用的物质是___________________(填化学式)。
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作名称是___________;进行该操作的方法是 。
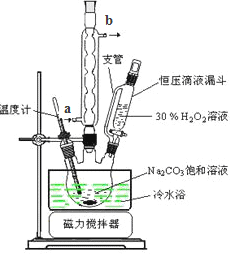
(6)实验室利用右图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是_______,冷凝管应从__________处进水。
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是_______________。
T/℃ | 活性氧百分含量 | 产率 |
5~10 | 13.94 | 85.49 |
10~15 | 14.02 | 85.78 |
15~20 | 15.05 | 88.38 |
20~25 | 14.46 | 83.01 |
查看答案和解析>>
科目: 来源: 题型:
【题目】当电池工作时,下列说法错误的

A. 甲池中N极的电极反应式为:O2+4e-+4H+=2H2O
B. 当N极消耗5.6L(标准状况下)O2时,铁极增重32g
C. 电子的流动方向为M→Fe→CuSO4溶液→Cu→N
D. M极上发生的是氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】过碳酸钠(2Na2CO33H2O2)俗称固体双氧水。实验室可用碳酸钠和双氧水等为原料来制备,具体流程如下:

已知:①相关反应的方程式如下:2Na2CO3+3H2O2=2Na2CO33H2O2△H<0
②工业上常以产品活性氧的质量分数[ω(活性氧)=![]() ×100%]来衡量产品的优劣,13.00%以上为优等品。
×100%]来衡量产品的优劣,13.00%以上为优等品。
请回答:
表1 反应温度对产品收率及活性氧含量的影响
反应温度/℃ | 产品收率/% | 活性氧质量分数/% |
5 | 65.3 | 12.71 |
10 | 73.2 | 13.24 |
15 | 85.0 | 13.55 |
20 | 83.2 | 13.30 |
25 | 55.1 | 12.78 |
表2加料时间对产品收率及活性氧含量的影响
加料时间/min | 产品收率/% | 活性氧质量分数/% |
5 | 65.7 | 13.30 |
10 | 76.8 | 14.75 |
15 | 81.3 | 14.26 |
20 | 89.0 | 13.82 |
25 | 87.9 | 13.51 |
(1)分析表1,一般选择的反应温度为_____。
(2)分析表2,加料时间对产品收率也有很大影响,时间太短或太长均不利于生产,加料时间太短导致产品收率较低的原因是_____。
(3)结晶过程中加入氯化钠,作用是_____。
(4)下列关于抽滤操作,正确的是_____。
A.准备略大于漏斗内径的滤纸,以盖住布氏漏斗瓷板上的小孔
B.用倾析法先转移溶液,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,加入少量水并开大水龙头,重复操作2~3次
D.用玻璃棒轻轻刮下抽滤得到的固体,晾干后保存在试剂瓶中
(5)使用图2所示装置抽滤,中途需停止抽滤时,最佳操作为_____。
(6)产品出厂前需测定活性氧的质量分数,现将0.1000g某厂的产品(所含杂质均不参与反应)溶于水配成溶液,加入10.00mL1.000molL﹣1的稀硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量_____,用0.1000molL﹣1的Na2S2O3标准溶液滴定,若该产品的活性氧质量分数为13.60%,则达到滴定终点时共消耗标准液的体积为_____mL。[已知:2Na2S2O3+I2=Na2S4O6+2NaI]
查看答案和解析>>
科目: 来源: 题型:
【题目】现有室温下浓度均为 1×10-3 mol·L-1 的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH 溶液。回答下列问题:
(1)上述 6 种溶液中,水电离出的 c(H+)最大的是_____(填序号,下同),最小的是_____。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③_______⑥(填“>”“<”或 “=”)。
(3)将等体积的①、⑤混合,则溶液的 pH__7(填“>”“<”或“=”),用离子方程式说 明其原因:_______。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为_____,最终产生 H2 总量的关系为_____(用“>”或“=”连接)。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的 pH 大小关系为①_______③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤______⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com