
科目: 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2气体和液体H2O时,放出445kJ热量,则下列热化学方程式中正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
D.![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) △H=-890kJ·mol-1
CO2(g)+H2O(l) △H=-890kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) ![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 0.9 | 1.0 | 0.6 |
(1)反应达到平衡时,CO的转化率为________。
(2)该反应的平衡常数K=________。
(3)恒温恒容条件下,可以说明反应已达到平衡状态的是________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(4)若将容器体积压缩到1 L,则达到新平衡时c(H2)的取值范围是__________。
(5)若保持容器体积不变,再充入0.6 mol CO和0.4 mol CH3OH,此时v正__v逆(填“>”“<”或“=”),平衡_____________移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示。

(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是
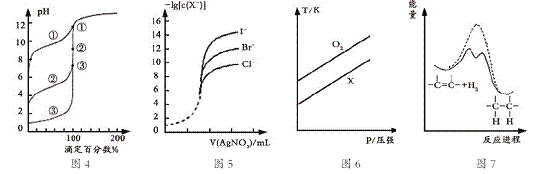
A.用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C.在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D.由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目: 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列微粒中中心原子的杂化方式和微粒的立体构型均正确的是( )
A.C2H4:sp、平面形
B.SO![]() :sp3、三角锥形
:sp3、三角锥形
C.ClO![]() :sp3、V形
:sp3、V形
D.NO![]() :sp3、正四面体
:sp3、正四面体
查看答案和解析>>
科目: 来源: 题型:
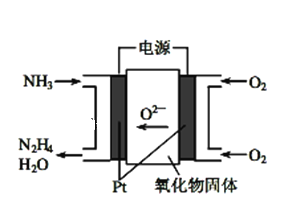
【题目】(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为______________________,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应_________________________;
(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式: _______________________________。
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式: _______________________________。
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
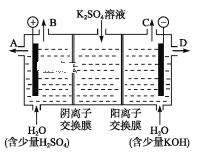
①该电解槽的阳极反应为_______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)_______导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(1)已知:2SO2(g)+ O2(g)![]() 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+ O2(g)![]() 2NO2 (g) △H2
2NO2 (g) △H2
NO2 (g) + SO2(g)![]() SO3(g) + NO(g) △H3
SO3(g) + NO(g) △H3
则△H3 =__________(用△H1、△H2表示),如果上述三个反应方程式的平衡常数分别为K1、 K2、K3,则K3 =__________(用K1、K2表示)。
(2)如图所示,A 是恒容的密闭容器,B 是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2mol NO 和1 mol O2通过K1、K3分别充入A、B 中,发生的反应为2NO(g)+ O2(g)![]() 2NO2 (g) [不考虑2NO2 (g)
2NO2 (g) [不考虑2NO2 (g)![]() N2 O4 (g) ],起始时A、B 的体积相同均为a L。
N2 O4 (g) ],起始时A、B 的体积相同均为a L。
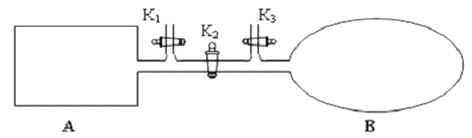
①下列说法和示意图正确,且既能说明A 容器中反应达到平衡状态,又能说明B 容器中反应达到平衡状态的是_________。
a. A、B 容器中气体的颜色均不再发生变化
b. A、B 容器中NO 和O2物质的量浓度比均为2:1

② T℃时,A 容器中反应达到平衡时的平衡常数Kp = 8×10﹣2 (kPa)﹣1。若A 容器中反应达到平衡时p(NO2) = 200kPa,则平衡时NO的转化率为_____________。(Kp 是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如 图实线 所示。
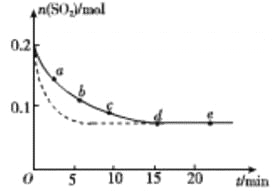
编号 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab 段平均反应速率____________(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为_________________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如图中虚线所示,则改变的条件是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
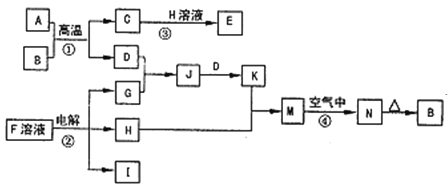
请回答下列问题:
(1)H的电子式是___,其中含有的化学键类型是___。
(2)写出反应④的现象:___,有关反应的化学方程式为___。
(3)已知I的燃烧热是-285.8kJmol-1,则1m3(标准状况)I完全燃烧,恢复至室温时放出的热量是__(计算结果保留3位有效数字)。
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2g气体,则此时溶液的pH是__(假设溶液的体积为2L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N。写出该反应的离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列的叙述中,正确的是( )
A.检验溴乙烷中的溴元素,加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成
B.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+ CO2 + H2O→2C6H5OH +![]()
C.苯酚能与FeCl3溶液反应生成紫色沉淀
D.苯酚有强腐蚀性,沾在皮肤上可用酒精清洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com