
科目: 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关系的表述中,正确的是
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 中和pH和体积都相同的硝酸和醋酸溶液,消耗NaOH的物质的量之比为1∶1
C. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(H2CO3)
)>c(H2CO3)
D. pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)![]() 溶液呈碱性的原因是 ______
溶液呈碱性的原因是 ______ ![]() 写出有关的离子方程式
写出有关的离子方程式![]() ,将
,将![]() 溶液跟
溶液跟![]() 溶液混合,相关反应的离子方程式是 ______ .
溶液混合,相关反应的离子方程式是 ______ .
(2)现有浓度均为![]() 的
的![]() 溶液与
溶液与![]() 溶液,试回答下列问题:
溶液,试回答下列问题:
![]() 大小:
大小:![]() ______
______ ![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 微粒种类:
微粒种类:![]() ______
______ ![]()
![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 两溶液分别加入
两溶液分别加入![]() 固体,恢复到原温度,
固体,恢复到原温度,![]() 溶液中的
溶液中的![]()
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() 、
、![]() 溶液中的
溶液中的![]() ______
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() .
.
(3)常温下,甲为![]() 的HA溶液,
的HA溶液,![]() ;乙为
;乙为![]() BOH溶液,且溶液中
BOH溶液,且溶液中![]()
![]() 请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
(4)相同条件下,对于浓度均为![]() 的NaCl溶液和
的NaCl溶液和![]() 溶液,溶液中的离子总数:NaCl溶液 ______
溶液,溶液中的离子总数:NaCl溶液 ______ ![]() 溶液
溶液![]() 填
填![]() 、
、![]() 、
、![]() .
.
(5)物质的量浓度相同的![]() 氨水
氨水![]() 氯化铵
氯化铵![]() 碳酸氢铵
碳酸氢铵![]() 硫酸氢铵
硫酸氢铵![]() 硫酸铵五种溶液中
硫酸铵五种溶液中![]() 由大到小的顺序是
由大到小的顺序是![]() 填写编号
填写编号![]() _____
_____
(6)浓度均为![]() 的6种溶液:
的6种溶液:![]()
![]()
![]()
![]()
![]()
![]() ,溶液pH值由小到大的顺序是
,溶液pH值由小到大的顺序是![]() 填写编号
填写编号![]() ______ .
______ .
(7)在钢铁发生的吸氧腐蚀中正极上的电极反应式为 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是
W(s)+3H2O(g),下列说法不正确的是
A. 增加H2O(g)的量,消耗H2的速率瞬间不变
B. 将容器的体积缩小一半,其反应速率加快
C. 保持体积不变,充入氩气,其反应速率不变
D. 保持压强不变,充入氖气,H2O(g)生成速率减慢
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1。
(2)向甲、乙两个均为1 L的密闭容器中,分别充入5 mol SO2和3 mol O2,发生反应:2SO2(g)+
O2(g)![]() 2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3 mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g) ![]() 2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
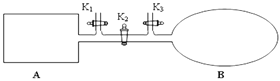
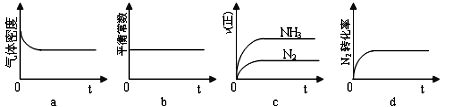
①下列示意图既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率υ(H2)=___________________________。
(4)将0.1 mol氨气分别通入1 L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为____________(用“c1、c2、c3和>、<、=”表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,求该温度下NH4Cl的水解常数K h 为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组欲制备并探究![]() 的某些性质。
的某些性质。
(1)下列实验方案适用于在实验室制取所需![]() 的是________。
的是________。
A.![]() 溶液与
溶液与![]()
![]() 固体与浓硫酸
固体与浓硫酸
C.固体硫在纯氧中燃烧 ![]() 高温煅烧硫铁矿
高温煅烧硫铁矿
(2)探究二氧化硫的漂白性
甲同学用如图所示装置![]() 气密性良好
气密性良好![]() 进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
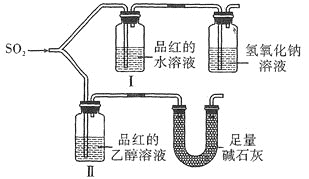
![]() 甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是________________,根据实验现象得出的实验结论是_____________。
甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是________________,根据实验现象得出的实验结论是_____________。
(3)乙同学设计用如图所示装置验证二氧化硫的化学性质。

![]() 能说明二氧化硫具有氧化性的实验序号为________
能说明二氧化硫具有氧化性的实验序号为________![]() 填字母
填字母![]() 。
。
![]() 为了验证c中
为了验证c中![]() 与
与![]() 发生了氧化还原反应,在上图装置中通入过量的
发生了氧化还原反应,在上图装置中通入过量的![]() 后,取c中的溶液,分成三份,并设计了如下实验:
后,取c中的溶液,分成三份,并设计了如下实验:
方案Ⅰ:往第一份试液中加入酸性![]() 溶液,紫色褪去;
溶液,紫色褪去;
方案Ⅱ:往第二份试液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:往第三份试液中加入用盐酸酸化的![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:______________________________________________。
![]() 试管e中发生反应的离子方程式为______________________________________________。
试管e中发生反应的离子方程式为______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+2B(g)=C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是
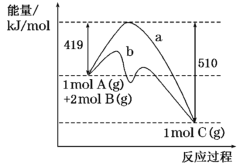
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.曲线b表示使用催化剂后的能量变化
D.该反应的焓变![]() H= -510 kJ·mol-1
H= -510 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。B、D、H 是气体,B 是单质,D 能使湿润的红色石蕊试纸变蓝;C、G 是生活中的常见金属,工业上用反应①制备 C;K、F 是固体,其中F 是一种红色涂料的主要成分。
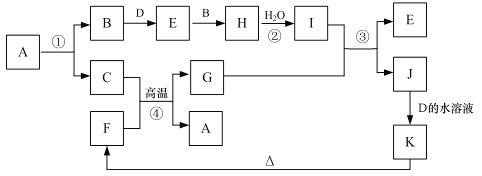
(1)K的化学式为___________;D 的电子式为____________。
(2)写出反应②的离子方程式: ___________。
(3)写出反应③的化学方程式,并用单线桥标出电子转移的方向和数目:_____________。
(4)物质J 常用作催化剂,媒染剂,放射性物质吸附剂。从J的溶液得到J的晶体的操作依次为_____________、冰水洗涤、减压烘干。冰水洗涤的目的___________。
(5)反应③常通过微热来加快反应的速率,加热时温度不能过高的原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuBr(溴化亚铜)是一种白色固体,不溶于水,在空气中会慢慢被氧化成绿色粉末,常用作催化剂,可用下图所示实验制得。
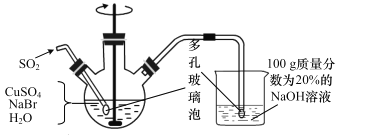
三颈烧瓶中的反应为 2Cu2++SO2+2Br-+2H2O=2CuBr↓+SO42-+4H+。
(1)实验所用蒸馏水需煮沸,目的是_______________。装置中使用多孔玻璃泡的目的是___________。
(2)将反应后得到的 CuBr 过滤并洗涤,检验 CuBr 是否洗净的方法是______。
(3)烧杯中若 NaOH 的量不足,则烧杯中最终所得溶液中的溶质是__________。
(4)CuBr 在空气中氧化所得绿色粉末为 xCuBr2·yCu(OH)2,为探究该粉末的化学式, 现进行如下实验:准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成 100 mL 溶液。
①取 25 mL 溶液,向其中加入足量的 AgNO3 溶液,充分反应后过滤、洗涤、干燥, 所得淡黄色固体质量为 0.94 g。
②另取 25 mL 溶液,向其中加入过量的 KI 溶液,再用 0.400mol·L-1Na2S2O3 标准溶液滴定至终点,消耗 25.00 mL。已知反应过程中的方程式如下:2Cu2++4I﹣=2CuI↓+I2、2S2O32-+I2=2I﹣+S4O62﹣。请确定该绿色粉末的化学式_________(需要计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com