
科目: 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
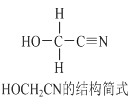
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目: 来源: 题型:
【题目】关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A. 该酸式盐的水溶液一定显酸性
B. 在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 若HY-能水解,水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. 若HY-能电离,电离方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
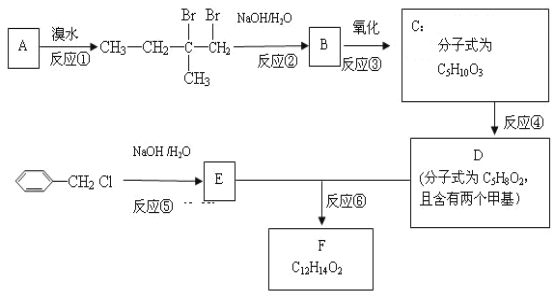
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现___种峰;
(2)C物质的官能团名称__;
(3)上述合成路线中属于取代反应的是___(填编号);
(4)写出反应①⑤的化学方程式:①___,⑤___;
由C可制备高聚物,其制备方程式为:___。
(5)已知:D分子的蒸气密度是H2密度的50倍,其红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱显示各峰面积之比为:1:1:3:3。并且该分子能与NaHCO3反应。
写出D的结构简式:___,F的结构简式:___。
(6)E属于芳香族化合物的同分异构体还有___种,其中苯环上只有3种等效氢的结构是:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.如图可表示水分解过程中的能量变化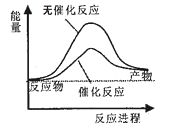
B.若2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) ΔH=-a kJ/mol,
Ⅱ:键能H-H:b kJ/mol,Cl-Cl:c kJ/mol。则断开1 mol H-Cl键所需能量为![]() kJ
kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应。
(1)该反应的化学方程式是:___。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图。
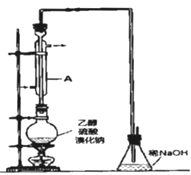
实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应.
请问答下列问题:
(2)装置A的作用是__。
(3)反应时若温度过高,观察到还有一种红棕色气体(Br2)产生,反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的____(填写上正确选项的字母)。
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳 d.Na2SO3溶液
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是____(填写正确选项的字母)。
a.分液 b.蒸馏 c.萃取
(5)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,通常采用的方法是取少量溴乙烷,然后___(按实验的操作顺序选填下列序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】以淀粉为基本原料可制备许多物质,如:

下列有关说法中正确的是
A.淀粉是糖类物质,有甜味,与纤维素互为同分异构体
B.反应③是消去反应,反应④是加聚反应,反应⑤是氧化反应
C.乙烯、聚乙烯分子中均含有碳碳双键,均可被酸性KMnO4溶液氧化
D.反应②是葡萄糖发生水解生成了CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50 mL0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
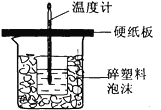
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是____。
(2)实验中改用20 mL0.50 mol/L的盐酸跟20 mL0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”);所求中和热的数值会___(填“相等”“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com