
科目: 来源: 题型:
【题目】某同学设计如图所示实验,探究反应中的能量变化。
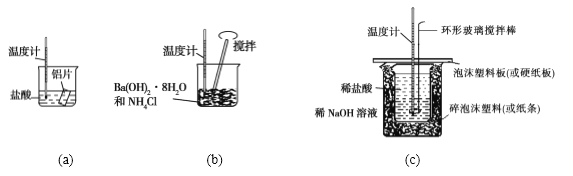
下列判断正确的是
A. 由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B. 将实验(a) 中的等质量的铝片换成铝粉后,释放出的热量有所增加
C. 实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D. 若用NaOH固体测定中和热,则测定结果偏高
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为_____;其最外层电子的电子云形状为_____。
(2)(NH4)2Fe(SO4)26H2O俗称摩尔盐
①![]() 电子式为___。
电子式为___。
②N、O两元素的第一电离能由大到小的顺序为___(用元素符号表示)。
③![]() 中S原子的杂化方式为___,VSEPR模型名称为___。
中S原子的杂化方式为___,VSEPR模型名称为___。
(3)K3[Fe(CN)6]晶体中中心原子的配位数为__,晶体的配位体为__(用化学符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是M元素高中常见物质的价类二维图。其中A到D、D到E的转化都可以加同—种物质实现,且E的相对分子质量比D的相对分子质量大16,下列说法正确的是
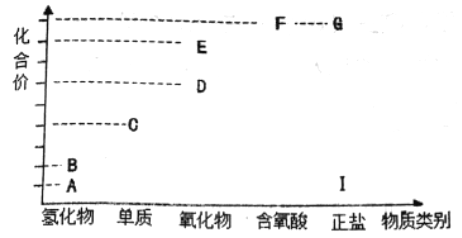
A.汽油燃料中主要含有M元素,所以汽车尾气中通常含有大量D而导致环境问题
B.检验Ⅰ中阳离子的方法:向其样品中加强碱,产生的气体可使湿润的蓝色石蕊试纸变红
C.物质F的浓溶液可以用铁制容器盛放
D.物质B可用作火箭燃料,其电子式为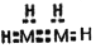
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是( )
A.18g H216O 和20g H218O 含有的质子数均为10NA
B.1L 1mol/L的KAl(SO4)2 溶液中阳离子总数为2NA
C.0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA
D.反应N2+3H2 ![]() 2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=7∶2时,2Al3++7OH―═Al(OH)3↓+[ Al(OH)4]―
B.向饱和Na2CO3溶液中通入过量CO2,CO32―+CO2+H2O═2HCO3―
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2)∶n(NaHS)=1∶2时,Cu2++2HS―═CuS↓+H2S↑
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,3Fe+2NO3―+8H+═3Fe2++2NO↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
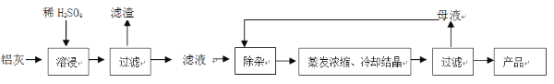
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com