
【题目】下列离子方程式书写不正确的是
A.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=7∶2时,2Al3++7OH―═Al(OH)3↓+[ Al(OH)4]―
B.向饱和Na2CO3溶液中通入过量CO2,CO32―+CO2+H2O═2HCO3―
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2)∶n(NaHS)=1∶2时,Cu2++2HS―═CuS↓+H2S↑
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,3Fe+2NO3―+8H+═3Fe2++2NO↑+4H2O
【答案】B
【解析】
定量的粒子之间的反应,注意量不同发生的反应不同、产物不同。
A.当n(OH-):n(Al3+)=7:2时,若n(Al3+)=2mol,则消耗6mol的OH-,发生Al3++3OH-═Al(OH)3↓其余的1molOH-反应:Al(OH)3+ OH-=[ Al(OH)4]-,A正确;B.向饱和Na2CO3溶液中通入过量CO2,由于碳酸氢钠的溶解度较小,有固体析出,B错误;C. HS-![]() H++S2-,Cu2++ S2-=CuS↓,导致平衡向右移动,溶液中的c(H+)增大,生成H2S气体,C正确;D. 当n(Fe)∶n(HNO3)=1∶4时,Fe+NO3―+4H+═Fe3++NO↑+2H2O,再增加1倍的Fe时,2Fe3++Fe=3Fe2+,铁过量,故D正确,答案为B。
H++S2-,Cu2++ S2-=CuS↓,导致平衡向右移动,溶液中的c(H+)增大,生成H2S气体,C正确;D. 当n(Fe)∶n(HNO3)=1∶4时,Fe+NO3―+4H+═Fe3++NO↑+2H2O,再增加1倍的Fe时,2Fe3++Fe=3Fe2+,铁过量,故D正确,答案为B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/molB.-109 kJ/molC.+109 kJ/molD.+218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%![]() 溶液洗涤,最后再用蒸馏水洗涤;
溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水![]() 干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
请回答下列问题:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作的注意事项是_______________________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是___________________________________。
(3)步骤④中洗涤粗硝基苯应使用的仪器是___________________________________________________。
(4)步骤④中粗产品用5%![]() 溶液洗涤的目的是___________________________________________。
溶液洗涤的目的是___________________________________________。
(5)纯硝基苯是无色、密度比水_______________________________(填“小”或“大”)的油状液体,它具有________味。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如图所示:

(1)化合物A的分子式是___;A中含有的官能团的名称是___。
(2)A、B、C、D四种化合物中互为同分异构体的是___。(填序号)
(3)化合物B的核磁共振氢谱中出现___组峰。
(4)1molD最多能与___mol的氢气发生加成反应;1molD与足量Br2水混合,最多能和___ molBr2发生反应
(5)已知C的一种同分异构体满足:①能够发生水解反应;②能够发生银镜反应;③能够使FeCl3溶液显紫色;④苯环上的一氯代物有2种。请写出它的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲烷与氯气在光照条件下反应,不涉及的实验现象是( )
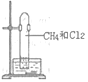
A.气体的黄绿色变浅至消失B.试管内壁上有油珠附着
C.试管内水面上升D.试管内有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是
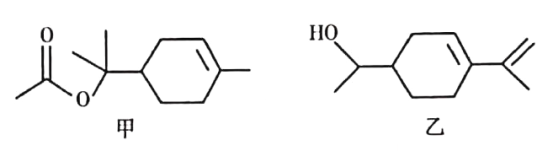
A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮(水中以NH3和NH4+形式存在的氮)含量是环境水体污染的一项重要指标,其氧化过程会造成水体中溶解氧浓度降低,导致水质下降,影响水生动植物的生长。
(1)水中NH3和NH4+两者的浓度比取决于水体的pH和水温。当pH偏高时,___比例较高,原因是___(请用离子方程式表示)。
(2)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH充分反应后,再向水中通入空气,可增大NH3的脱除率,用平衡移动原理解释其原因:___。
(3)在微生物作用下,蛋白质在水中分解产生的NH3能够被O2氧化生成亚硝酸(HNO2)。
___NH3+__O2→__HNO2+__________
①请将上述化学方程式补充完整,并配平。
②反应中氧化剂与还原剂的物质的量之比为___。
③若反应中有0.6mol电子发生转移,生成亚硝酸的质量为___。
(4)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示。DO的测定原理如下:
①2Mn2++O2+4OH-→2MnO(OH)2↓
②MnO(OH)2+2I-+4H+→Mn2++I2+3H2O
③2S2O32-+I2→S4O62-+2I-
某小组同学取100.00mL水样经反应①和②后,取出20.00mL溶液,以淀粉作指示剂,用amol/LNa2S2O3溶液进行滴定,终点现象为___;滴定消耗Na2S2O3溶液bmL,水样的DO=____mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以乙醇为原料制备少量1,2—二溴乙烷的相关装置如图所示。下列说法正确的是( )

A.用装置甲制取乙烯,加热混合液使温度缓慢上升至170℃
B.用装置乙净化乙烯,瓶中盛放的试剂可以是KMnO4酸性溶液
C.用装置丙制备1,2—二溴乙烷,冰水浴、液溴液面上加少量水等措施均可减少Br2的挥发
D.用装置丁净化尾气,可除去尾气中的Br2和未反应的乙烯气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com