
【题目】实验室以乙醇为原料制备少量1,2—二溴乙烷的相关装置如图所示。下列说法正确的是( )

A.用装置甲制取乙烯,加热混合液使温度缓慢上升至170℃
B.用装置乙净化乙烯,瓶中盛放的试剂可以是KMnO4酸性溶液
C.用装置丙制备1,2—二溴乙烷,冰水浴、液溴液面上加少量水等措施均可减少Br2的挥发
D.用装置丁净化尾气,可除去尾气中的Br2和未反应的乙烯气体
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=7∶2时,2Al3++7OH―═Al(OH)3↓+[ Al(OH)4]―
B.向饱和Na2CO3溶液中通入过量CO2,CO32―+CO2+H2O═2HCO3―
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2)∶n(NaHS)=1∶2时,Cu2++2HS―═CuS↓+H2S↑
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,3Fe+2NO3―+8H+═3Fe2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列事实的解释错误的是( )
A.在蔗糖中加入浓硫酸后岀现发黑现象,说明浓硫酸具有吸水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.氨溶于水的喷泉实验,说明氨气极易溶于水
D.向碘水中滴加CCl4,振荡静置分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3,另一极为金属锂和石墨的复合材料,电解质只传导锂离子。电池总反应为:Fe2O3+6Li![]() 2Fe+3Li2O,关于此电池,下列说法不正确的是
2Fe+3Li2O,关于此电池,下列说法不正确的是
A.放电时,此电池逐渐靠近磁铁
B.放电时,正极反应为Fe2O3+6Li++6e-= 2Fe+3Li2O
C.放电时,正极质量减小,负极质量增加
D.充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:

回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯( )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、氮、氧、硫,镁,铁、铜,锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断Mg基态原子的核外电子排布为,
![]()
该同学所画的电子排布图违背了________________________________.
(2)Fe位于___________族_______区,Fe2+价电子排布式为_____________。
(3)MgCO3的分解温度____ BaCO3 (填“>” 或、“<”)
(4)C、N、O元素的第一电离能由大到小的顺序为_________________
(5)1mol[Cu(NH3)2]+中含有σ键的数目为___________
(6)下列有关说法不正确的是____。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 , 原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体Cu的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________,设Cu原子半径为a,晶体的空间利用率为______。(用含π,a、的式子表示,不必化简)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
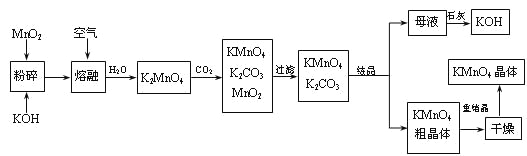
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图一:

已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6,密度为0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是___。
(2)步骤①中通入氮气的目的是___。
(3)仪器c的适宜容积应为(选编号):___。
①100mL ②250mL ③500mL
(4)步骤⑤用盐酸洗涤的目的是___。
(5)步骤⑦是二茂铁粗产品的提纯,该过程在图二中进行,其操作名称为___;该操作中棉花的作用是___。
(6)若最终制得纯净的二茂铁4.3g,则该实验的产率为___(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列8种与人们生产生活相关的有机物:① HCHO(防腐剂)② CH3CH2CHO(化工原料)③CH3CH2CH2CH3(打火机燃料)④ ![]() (冷冻剂)⑤
(冷冻剂)⑤ ![]() (汽车防冻液)⑥
(汽车防冻液)⑥ ![]() (杀菌剂)⑦
(杀菌剂)⑦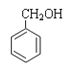 (定香剂)⑧
(定香剂)⑧ ![]() (汽油添加剂)请回答:
(汽油添加剂)请回答:
(1)属于醇的是____(填序号,下同)。
(2)互为同系物的是_____。
(3)互为同分异构体的是__。
(4)用系统命名法给④命名,其名称为_____。
(5)写出②与银氨溶液发生银镜反应的化学方程式__。
(6)写出⑧与浓硝酸反应生成TNT的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com