
科目: 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=![]() ,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A.降低温度,正反应速率增大
B.增大c(A)、c(B),K增大
C.向容器中充入稀有气体X,压强增大,反应速率不变
D.该反应的化学方程式为2E(g)+F(s)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃_____400℃(填“>”或“<”),该反应的ΔH____0(填“>”或“<”)。
②该反应自发进行的条件是__________(填高温、低温、任何温度)。
③对该反应,下列说法正确的是_________(填选项字母)。
A. 若容器内气体密度不变,则表明反应达到平衡状态
B. 若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C. 反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D. 反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)NHCl2(l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式______________________________。
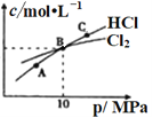
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)____α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】立方烷(C8H8)其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是

A. 立方烷在空气中可燃,燃烧有黑烟产生
B. 立方烷一氯代物1种、二氯代物有3种
C. 立方烷是苯(C6H6)的同系物,也是苯乙烯(C6H5-CH=CH2)的同分异构体
D. 八硝基立方烷完全分解可能只产生二氧化碳和氮气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释过程或事实的方程式不正确的是( )
A.氯气用于自来水消毒:Cl2+H2O=HCl+HClO
B.铁可以和稀硫酸反应:2Fe+3H2SO4=Fe2(SO4)3 +3H2↑
C.刻制印刷电路板时常用氯化铁溶液作为“腐蚀液”刻蚀铜板 2Fe3++Cu=2Fe2++ Cu2+.
D.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe + 4H2O(g)![]() Fe3O4 + 4H2
Fe3O4 + 4H2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W 是中学化学中常见的四种不同粒子,其中X、W 为分子,Y、Z为离子它们之间存在如下所示的转化关系:
X+Y→Z+W Z+H+ →X Y+H+ →W
(1)如果X、Y、Z、W 均是10电子的粒子,请写出:
X的电子式:____________; W 的电子式:_________________。
(2)如果X和Z均是18电子的粒子,Y 和 W 均是10电子的粒子,请写出:
①X与Y(足量)在溶液中反应的离子方程式:______________________。
②根据上述离子方程式,可判断Z与 Y 结合质子(H+ )的能力大小是 ________ >_____ 。(用化学式或离子符号表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
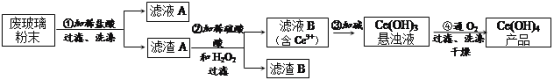
(1)洗涤滤渣A的目的是为了去除_______(填离子符号),检验该离子是否洗涤的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________,滤渣B的主要成分是_________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有_________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000molL-1FeSO4标准溶液滴定终点是(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,2gC2H2(g)完全燃烧生成液态水时放出的热量是100kJ,则C2H2燃烧的热化学方程式是_________________________ 。
(2)已知:C(石墨,s)+O2(g) = CO2(g) △H = —393.5kJ·mol—1,C(金刚石,s)+ O2(g) =CO2(g) △H =—395.0kJ·mol—1,则反应C(石墨,s) = C(金刚石,s) △H =______kJ·mol—1。由此可知,石墨和金刚石相比更稳定的是 _______(填“石墨”或“金刚石”)。
(3)已知H2(g)的燃烧热△H 1=—285.0kJ·mol—1,CO(g)的燃烧热△H 2=—283.0kJ·mol—1, CH3OH(l)的燃烧热△H3=—726.0kJ·mol—1。0.2mol由H2 和CO组成的混合气体在完全燃烧时放出56.8kJ的能量,则混合气体中H2 和CO的质量比为_________。工业上在催化剂的作用下,可用H2(g)和CO(g)合成CH3OH(l)。请写出由H2(g)和CO(g)合成CH3OH(l)的热化学方程式:_______________________。
(4)强酸和强碱的稀溶液的中和热可表示为 H+ (aq)+OH— (aq) = H2O(l) △H =—57.3kJ·mol—1。已知:CH3COOH(aq)+NaOH(aq) = CH3COONa(aq)+H2O(l) △H =—33.1kJ·mol—1。请写出醋酸溶液电离的热化学方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.C5H10共有8种同分异构体(不考虑立体异构)
B.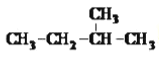 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C.CH3COOCH2CH3 和CH3CH2COOCH3互为同分异构体
D.苯甲醇和苯酚互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸(HNO2)是一元弱酸,不稳定,只能存在于较低温度的稀溶液中。室温时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数Ka1=4.2×10-7、Ka2=5.61×10-11。亚硝酸及其盐在实验和工业生产中有重要应用。请回答:
(1)在酸性条件下,NaNO2与KI按物质的量1︰1恰好完全反应,I-被氧化为I2,写出该反应的离子方程式________________。
(2)NaNO2溶液呈_____性(填“酸”“碱”或“中”),原因是________(用离子方程式表示)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用______(填序号)。
a.稀H2SO4 b.CO2 c.SO2
(3)若用电解法将废水中NO2-转换为N2除去,N2将在__________(填电极名称)生成。
(4)向含1 mol Na2CO3的溶液中加入1 mol HNO2后,c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为________________。
(5)25℃时,用0.100molL-1NaOH溶液滴定20.0mL某浓度的HNO2溶液,溶液的pH与NaOH溶液体积(V)的关系如图所示,(在该条件下HNO2不分解)
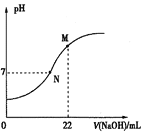
已知:M点对应溶液中,c(OH-)=c(H+)+c(HNO2)。则:
①原溶液中c(HNO2)为_________。
②下列关于N点对应溶液的说法正确的是______(填选项字母)。
A.溶质只有NaNO2
B.水电离出来的c(H+)=1×10-7 molL-1
C.溶液中:c(Na+)<c(OH-)
D.溶液中离子浓度:c(Na+)= c(NO2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列问题:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置______,基态E2+价电子的排布图为_______,B元素能量最高的电子其轨道呈_______形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________,B、C、D简单离子的半径由大到小的顺序为_________。
(4)写出C的核外有18个电子的氢化物的电子式________。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________。
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com