
科目: 来源: 题型:
【题目】化学与生产、生活、社会密切相关,请根据学过化学知识解答下列问题
(1)由下列物质冶炼相应金属时采用电解法的是___________。
a.Cu2S b.NaCl c.Fe2O3 d.HgS
(2) 银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:4Ag+2H2S+O2=2Ag2S+2H2O。当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原。原理是形成了原电池,该原电池的负极反应物为:______。
(3)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
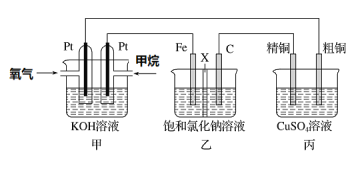
①通入甲烷的电极为________(填“正极”或“负极”),该电极反应式为___________。
②乙装置工作一段时间后,结合化学用语解释铁电极附近滴入酚酞变红的原因:____________。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
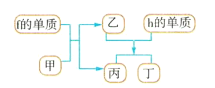
请写出h的单质与乙反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素的离子结构示意图为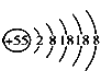 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
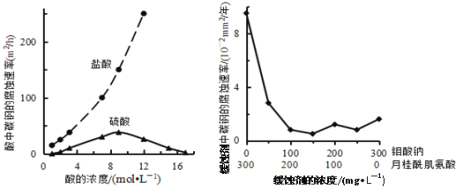
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓氨水 | NaOH | 酚酞 | NaOH的碱性比 NH3H2O的强 | |
B | 浓盐酸 | MnO2 | 淀粉溶液 | 非金属性:氯元素大于碘元素 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)CO2(g)+H2(g)。
(1)平衡常数的表达式K=_________________________
(2)向1L恒容密闭容器中充入CO和H2O(g),某温度时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为__________;该温度下反应的平衡常数K=________(小数点后保留2位有效数字)。
(3)已知该反应在不同的温度下的平衡常数数值分别为
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.19 | 1.00 | 0.60 | 0.38 |
①根据表中的数据判断,该反应为________(填“吸热”或“放热”)反应。
②800℃,向2L恒容密闭容器中充入1molCO(g)、1molH2O(g)、2molCO2(g)、2molH2(g),此时v正_______v逆 (填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.石油裂化可以提高汽油等轻质油的产量和质量
B.分子式为C5H12的同分异构体共有3种
C.向2mL碘水中加入1mL苯,振荡后静置,可观察到液体分层,上层呈紫红色
D.煤中含有苯和甲苯,可用干馏的方法将它们分离开来
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
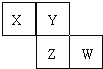
A.原子半径:W > Z > Y > X
B.最高价氧化物对应水化物的酸性:Z > W
C.4种元素的单质中Z单质的熔、沸点最低
D.W单质能与水反应生成一种具有漂白性的物质
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知![]() 为阿伏伽德罗常数的值):
为阿伏伽德罗常数的值):
试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式:___,当该反应以实验①中数据反应完全时转移电子数为_____![]() 。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______,V2=__________。
(3)根据实验①、②的数据,可以得到的结论是____。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的新假设是__________。
②若该小组同学提出的假设成立,应观察到__________(填实验现象)。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答或解释下列问题:
(1)已知:P4(白磷,s) =4P(红磷,s) ΔH=-a kJ·mol-1(a>0),则稳定性:白磷_______红磷(填“大于”或“小于”)。
(2)在常温常压下,1 g 氢气在足量氯气中完全燃烧生成氯化氢气体,放出91.5 kJ 的热量。写出相应的热化学方程式为____________;
(3)将浓氨水滴入到固体氢氧化钠中,可以快速制备氨气,用平衡移动原理解释原因:____________;
(4)常温下,用0.1mol·L-1 NaOH溶液分别滴定20.00 mL 0.1mol/L HCl溶液和20.00 mL0.1 mol/L CH3COOH溶液,得到2条滴定曲线如图所示:
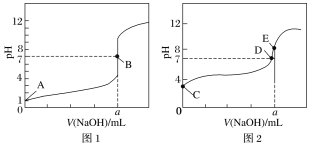
①由A、C点判断,滴定HCl溶液的曲线是__________(填“图1”或“图2”)。
②a=________ mL。
③D点对应离子浓度由大到小的顺序为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com