
科目: 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
A.CaCl2和 Na2S B.Na2O 和 Na2O2
C.CO2和CaO D.HC1 和 NaOH
(2)已知1 mol石墨转化为1 mol金刚石要吸收能量,则1 mol石墨的能量比1 mol金刚石的能量____(填“高”或“低”),石墨比金刚石_______(填“稳定”或“不稳定”)。
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是____________,该反应是___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。
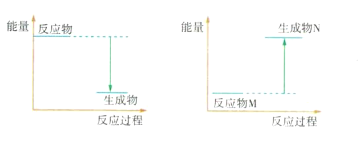
图1 图2
(4)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___________________________。
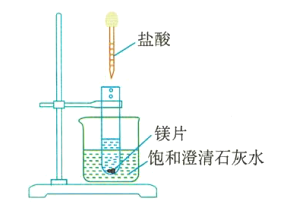
图3
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置 | 编号 | 试剂X | 实验现象 |
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。
(2)甲同学探究实验I的电极产物______________。
①取少量Na2SO3溶液电极附近的混合液,加入______________,产生白色沉淀,证明产生了![]() 。
。
②该同学又设计实验探究另一电极的产物,其实验方案为______________。
(3)实验I中负极的电极反应式为______________。
(乙同学的实验)
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置 | 编号 | 反应时间 | 实验现象 |
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3![]()
![]() Fe(OH)3 +3SO2;②______________。
Fe(OH)3 +3SO2;②______________。
(5)查阅资料:溶液中Fe3+、![]() 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________。
(6)解释30 min后上层溶液又变为浅红色的可能原因:______________。
(实验反思)
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)为探究实验室制取氢气的合适条件,探究学习小组用如图所示装置制取氢气。

①仪器b的名称是___,若用锌粒和3molL-1H2SO4制取氢气可选用上述仪器中的___(填字母序号)组成氢气的制备和收集装置。
②实验测得H2的生成速率如图2所示:
根据t1~t2时间速率变化判断该反应是___反应(填“吸热”或“放热”)。t2~t3时间速率变化的主要原因是___。
③若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是___。
(2)已知:化学键的键能是指气态原子间形成1mol化学键时释放的能量。几种化学键的键能如下表所示:
键能(kJmol-1) | |
H-H | 436 |
S=S | 255 |
H-S | 339 |
1molS2(g)与足量H2完全反应生成H2S,放出___kJ的热量。
(3)以H2为原料设计成氢氧燃料电池,电池的构造如图3所示,下列说法正确的是___(在原电池中发生氧化反应的电极称为负极)。
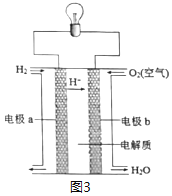
A.电极b是该电池的正极 B.该电池的能量转化率可达100%
C.可用蔗糖溶液作电解质溶液 D.供电时的总反应为:2H2+O2=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl △H<0。
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去。
可选用的药品有:①石灰石②生石灰③6mol/L盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
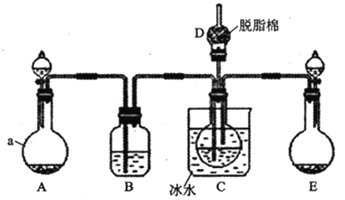
请回答下列问题:
(1)仪器a的名称是___。
(2)B中应选用的药品是___(填序号)
(3)在实验过程中,应先向C中通入的气体的化学式是___,其原因是___。
(4)D中脱脂棉应浸润的试剂是___(填写字母编号)。
a.浓硫酸 b.稀硫酸 c.氢氧化钠溶液 d.浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),先将晶体充分干燥后,称量质量为wg,然后进行如图所示实验:

①操作Ⅲ中的方法是___,___,___。
②所得晶体中碳酸氢钠的纯度是___(不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 |
| 142 |
| 2560 | Br- | 64 |
Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。
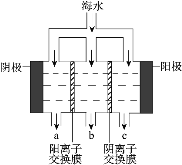
①电解氯化钠溶液的离子方程式_____。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因_____。 在阴极附近产生少量白色沉淀,其成分有_________和CaCO3。
③淡水的出口为_________(填“a”、“b”或“c”);a 出口物质为_____(填化学式)。
④若用下面燃料电池为电源电解 100mL1molL-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为__________(忽略反应前后溶液体积变化)
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,
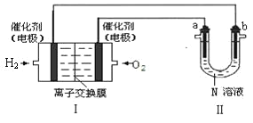
①Ⅰ中通入O2的一端为电池的_____极。 通入H2的一端的电极反应式_________
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是_____,N 溶液为_____溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是_____,N 溶液为 _____溶液。
(3)工业上用 Na2SO3 溶液吸收 SO2,过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n(![]() ):n(
):n(![]() ) 变化关系如下表:
) 变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:

①![]() 在阳极放电的电极反应式是_____。
在阳极放电的电极反应式是_____。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
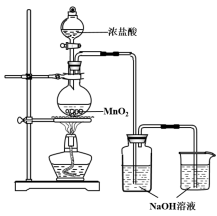
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
a. 测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
b. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(1)写出利用上述装置制备消毒液涉及反应的化学方程式 、 。
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有 性。
(3) 该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
① 操作b中溶液变成黄绿色的原因: (用离子方程式表示)。
② 有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是 。
(4) 有效氯的含量是检测含氯消毒剂消毒效果的重要指标。具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上。小组同学进行如下实验测定有效氯:取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加几滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-) 。注:相对原子质量Cl35.5,Na23,S32,O 16 ,I 127, K39
①达到滴定终点时的实验现象是 。
②此消毒液有效氯含量为 %(保留一位有效数字)。获得结论:此实验制得的消毒液 (填“符合”或“不符合”)家用要求。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的固定和氮的循环是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K 值。
反应 | 大气固氮N2(g)+O2(g) | 工业固氮N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:人类不适合大规模模拟大气固氮的原因____。
②从平衡视角考虑工业固氮应该选择常温条件,但实际工业生产却选择 500℃左右的高温, 解释其可能的原因_____。
(2)工业固氮反应中,在其他条件相同时,分别测定 N2 的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是_____(填“A”或“B”);比较р1、р2的大小关系_____。
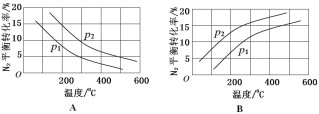
(3)下图是某压强下,N2 与H2 按体积比1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
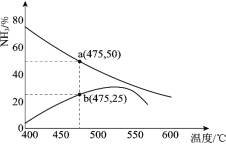
①图中b 点,v(正)_____v(逆)。(填“>”、“=”或“<”)
②图中a 点,容器内气体 n(N2):n(NH3)=_____。
(4)已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ·mol-1;2H2(g) +O2(g)
2NH3(g)△H=-92.4kJ·mol-1;2H2(g) +O2(g)![]() 2H2O(l)△H=-575.6kJ·mol-1;近年,又有科学家提出在常温、常压、催化剂等条件下氮气与液态水合成氨气,同时产生氧气的新思路,则该反应的热化学反应方程式为:_____。
2H2O(l)△H=-575.6kJ·mol-1;近年,又有科学家提出在常温、常压、催化剂等条件下氮气与液态水合成氨气,同时产生氧气的新思路,则该反应的热化学反应方程式为:_____。
(5)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH=﹣1298kJ/mol
ⅱ.
① 断开 1 mol H-O 键与断开 1 mol H-N 键所需能量相差约_____kJ;
② H-O 键比 H-N 键(填“强”或“弱”)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2![]() 2CO2+ 4H2O。下列说法不正确的是
2CO2+ 4H2O。下列说法不正确的是
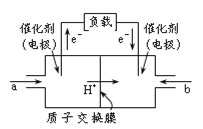
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___
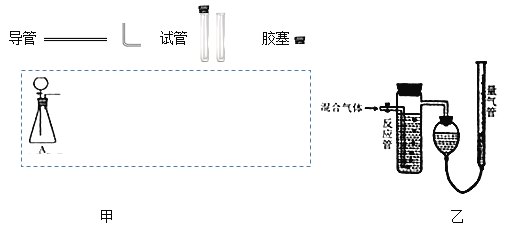
(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题:
(1)下列过程不一定释放能量的是________。
A. 化合反应 B. 分解反应 C. 形成化学键 D. 燃料燃烧 E. 酸碱中和 F. 炸药爆炸
(2)等质量的下列物质分别完全燃烧生成![]() ,放出热量较多的是________。
,放出热量较多的是________。
A. 硫蒸气 B. 硫固体
(3)已知:通常条件下,强酸强碱稀溶液中和生成![]() 水放出的热量为中和热。稀溶液中
水放出的热量为中和热。稀溶液中![]() 和
和![]() 恰好完全反应时放出
恰好完全反应时放出![]() 热量,则其中和热为________
热量,则其中和热为________![]() 。
。
(4)已知![]() 和
和![]() 反应生成
反应生成![]() 是放热反应,且断开
是放热反应,且断开![]() 键、
键、![]() 键、
键、![]() 键需吸收的能量分别为
键需吸收的能量分别为![]() 、
、![]() 、
、![]() 。由此可以推知下列关系正确的是________(填序号)。
。由此可以推知下列关系正确的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]()
D. ![]() E.
E. ![]() F.
F. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com