
科目: 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
![]() 已知:
已知:![]() ,则反应
,则反应![]() ______ 。
______ 。
![]() 天然气的一个重要用途是制取
天然气的一个重要用途是制取![]() ,其原理为:
,其原理为:![]() 。一定条件下,在密闭容器中,通入物质的量浓度均为
。一定条件下,在密闭容器中,通入物质的量浓度均为![]() 的
的![]() 与
与![]() ,在发生反应时,测得
,在发生反应时,测得![]() 的平衡转化率与温度及压强的关系如图1所示,
的平衡转化率与温度及压强的关系如图1所示,
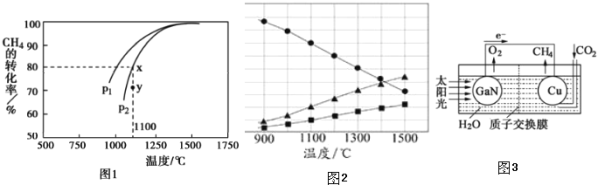
![]() 该反应的平衡常数表达式为______ 。
该反应的平衡常数表达式为______ 。
![]() 压强
压强![]() ______
______ ![]() 填“大于”或“小于”
填“大于”或“小于”![]() ;压强为
;压强为![]() 时,在Y点:
时,在Y点:![]() 正
正![]() ______
______ ![]() 逆
逆![]() 填“大于“、“小于”或“等于“
填“大于“、“小于”或“等于“![]() 。
。
![]() 天然气中的少量
天然气中的少量![]() 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为![]() 。一定条件下向
。一定条件下向![]() 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______ 。
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______ 。
![]() 工业上又常将从天然气分离出的
工业上又常将从天然气分离出的![]() ,在高温下分解生成硫蒸气和
,在高温下分解生成硫蒸气和![]() ,若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,
,若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,![]() 在高温下分解反应的化学方程式为______ 。
在高温下分解反应的化学方程式为______ 。
![]() 科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。
![]() 写出铜电极表面的电极反应式为______ 。
写出铜电极表面的电极反应式为______ 。
![]() 为提高该人工光合系统的工作效率,可向装置中加入少量______
为提高该人工光合系统的工作效率,可向装置中加入少量______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】ZnSe是一种光电性能优异的半导体材料,某研究小组用如图1方法制备了ZnSe.

![]() 溶于水生成
溶于水生成![]() ,下列物质与水反应,跟此反应类型相同的是 ______
,下列物质与水反应,跟此反应类型相同的是 ______
![]()
![]()
![]()
![]()
![]()
![]() 硒酸
硒酸![]() 的水溶液按下式发生一级和二级电离:
的水溶液按下式发生一级和二级电离:![]() ;
;![]() ,
,![]()
![]() 溶液显 ______
溶液显 ______ ![]() 填“酸性”、“中性”、“碱性”
填“酸性”、“中性”、“碱性”![]() .
.
![]() 向
向![]() 溶液中滴加少量氨水,该反应的离子方程式为 ______ .
溶液中滴加少量氨水,该反应的离子方程式为 ______ .
![]() 已知
已知![]() 的两级电离常数分别为
的两级电离常数分别为![]() ,
,![]() ,则
,则![]() 和
和![]() 两溶液混合后反应的离子方程式为 ______ .
两溶液混合后反应的离子方程式为 ______ .
![]() 肼
肼![]() 与
与![]() 反应的氧化产物是
反应的氧化产物是![]() 氧化剂与还原剂的物质的量之比为 ______ .
氧化剂与还原剂的物质的量之比为 ______ .
![]() 电化学降解法可用于治理水中硝酸盐的污染,所得产物可直接排入大气.其原理如图2所示,其中B为电源的 ______ 极,乙池中电极反应式为 ______ ,为使反应持续进行,须适时向甲池中添加 ______ .
电化学降解法可用于治理水中硝酸盐的污染,所得产物可直接排入大气.其原理如图2所示,其中B为电源的 ______ 极,乙池中电极反应式为 ______ ,为使反应持续进行,须适时向甲池中添加 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】从海水中提取镁的流程如图所示(框图中是主要产物):
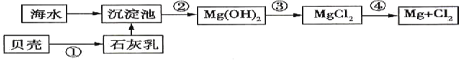
请回答相关问题。
(1)下列说法不正确的是____________。
A.上述方法的优点之一是原料取自大海 B.进行①②③步骤的目的是富集![]()
C.工业上也可用电解熔融氧化镁的方法制取镁 D.电解法冶炼金属要消耗大量的电能
(2)步骤③中发生反应的离子方程是__________________________。
(3)步骤④中发生反应的化学方程式是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
a.碳棒b.锌板c.铜板

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为____________________________________________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________________________________________________________________________。

(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_______________________________________________________。
②若有2mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,![]() 某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为
某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为![]() ;若用足量碱石灰吸收燃烧产物,则碱石灰增重
;若用足量碱石灰吸收燃烧产物,则碱石灰增重![]() 。
。
(1)计算燃烧产物中水的质量_____________。
(2)若原气体是单一气体,通过计算推断它的分子式___________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式________________(只要求写出一组)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应;乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性气体杂质,由此他提出必须先除去杂质,再让乙烯与溴水反应。请回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴发生了加成反应,其理由是________(填序号)。
①使溴水褪色的反应不一定是加成反应
②使溴水褪色的反应就是加成反应
③使溴水褪色的物质不一定是乙烯
④使溴水褪色的物质就是乙烯
(2)乙同学推测此乙烯中一定含有的一种杂质气体是________,它与溴水反应的化学方程式是________________。在实验前必须全部除去,除去该杂质的试剂可用________。
(3)为验证乙烯与溴发生的反应是加成反应而不是取代反应,丙同学提出可用![]() 试纸来测试反应后溶液的酸性,理由是_____________________________________________________________________________。
试纸来测试反应后溶液的酸性,理由是_____________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:![]()
![]() 在含
在含![]() 价铬的废水中加入一定量的硫酸和硫酸亚铁,使
价铬的废水中加入一定量的硫酸和硫酸亚铁,使![]() 价铬还原成
价铬还原成![]() 价铬;再调节溶液pH在
价铬;再调节溶液pH在![]() 之间,使
之间,使![]() 和
和![]() 转化为
转化为![]() 、
、![]() 沉淀而除去.
沉淀而除去.
![]() 写出
写出![]() 与
与![]() 溶液在酸性条件下反应的离子方程式 ______ .
溶液在酸性条件下反应的离子方程式 ______ .
![]() 用离子方程式表示溶液pH不能超过10的原因 ______ .
用离子方程式表示溶液pH不能超过10的原因 ______ .
![]() 将含
将含![]() 价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的
价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的![]() 和
和![]() 发生反应,生成的
发生反应,生成的![]() 和
和![]() 在阴极区与
在阴极区与![]() 结合成氢氧化物沉淀而除去.
结合成氢氧化物沉淀而除去.
![]() 写出阴极的电极反应式 ______ .
写出阴极的电极反应式 ______ .
![]() 电解法中加入氯化钠的作用是 ______ .
电解法中加入氯化钠的作用是 ______ .
![]() 某化学兴趣小组以含
某化学兴趣小组以含![]() 价铬和
价铬和![]() 价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
![]() 取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
![]() 取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水
取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水![]() ______ 时,锰、铬去除率最好.
______ 时,锰、铬去除率最好.

查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,它与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:

(1)元素Ga位于Al的下一周期,写出镓(Ga)的原子结构示意图为____________CO2的电子式为_____________________
(2)下列有关Al、Ga的说法不正确的是______
A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
(3)图中涉及到的Al、Na、O三种元素简单离子半径由大到小的顺序_____________
(4)步骤二中不能通入过量的CO2,理由_________________(用离子方程式表示)
(5)工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含Zn、Fe、Cu杂质,以NaOH水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:Zn2+<Ga3+<Fe2+)
①下列有关电解精炼说法正确的是_______
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式__________________________________
(6)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。氮化镓(GaN)的一种制备方法是采用GaCl3与NH3在一定条件下反应,写出该反应的化学方程式__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com