
科目: 来源: 题型:
【题目】肼(N2H4)又称联氨,是火箭常用的高能燃料,常温下为液体,其球棍分子模型如图所示。肼能与双氧水发生反应 N2H4+2H2O2=N2+4H2O,用 NA表示阿伏加德罗常数的值。下列说法正确的是
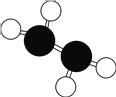
A.N2H4属于共价化合物,分子中只含有极性共价键
B.标准状况下,22.4 L N2H4中含有的原子总数为 6NA
C.标准状况下,3.2 g N2H4中含有共价键的总数为 0.6NA
D.若生成 3.6g H2O,则上述反应转移电子的数目为 0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
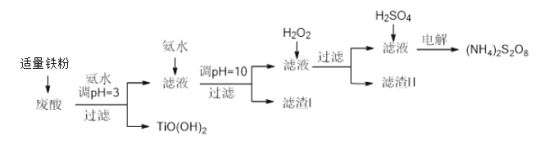
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是________________________。
(2)生成TiO(OH)2的化学方程式是____________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是________
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++____________+4H2O +H2O2=___________+ 4NH3·H2O。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
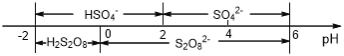
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为_________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=___________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =___________(列式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g) ![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=________。在保证A浓度不变的情况下,扩大容器的体积,平衡______(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时_________________________。
②t2时平衡向___________________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
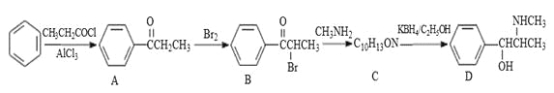
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知:![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线: 。
的合成路线: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期元素X、Y、Z、M、N、O、P,原子序数逐渐增大,其中X、Y、Z、M、N为短周期元素,而X、Y、Z、M处于同周期的P区,且未成对电子数之比为1:2:3:2;N与Z同族。O、P分别位于周期表第2、4列,P的单质被称为“未来金属”,具有质量轻、强度大、耐腐蚀性好的优点。
(1)Y、Z、M三种元素的电负性由大到小的顺序:________(用元素符号表示)。
(2)M的常见氢化物的氢键的键能小于HF的氢键的键能,但Z的常见氢化物常温下为液态而HF常温下为气态的原因是:__________。
(3)XN一种耐磨涂料,可用于金属表面保护层,该化合物可由X的三溴化物和N的三溴化物于高温下在氢气的氛围中合成。
①写出合成XN的化学方程式:_________。(各物质用化学式表示)
②XN的晶体的晶胞如图所示:
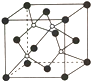
其中实心球为N,在一个晶胞中N原子空间堆积方式为______,N原子的配位数为______;该结构中有一个配位键,提供空轨道的原子是________(写元素符号)。
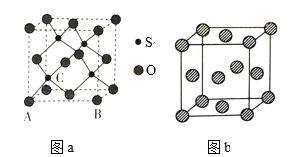
(4)O和硫形成的某种晶体的晶胞如图a所示:该晶胞原子的坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为_______。
(5)图b为P的一种面心立方晶胞结构,若晶胞的边长为anm,则P的密度为_____g·cm-3(用含a和NA的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。

(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列叙述错误的是
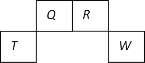
A.元素的非金属性:Q 强于 W
B.T 的氧化物能与 NaOH 溶液反应
C.R 元素的气态氢化物能与其最高价氧化物对应的水化物反应
D.Q 和 W 元素形成化合物 QW2分子中,各原子的最外层均满足 8 电子的稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】取1 mol A和a mol B使其发生反应A(g)+aB(g)![]() bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的
bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的![]() 倍,则a、b可能是( )
倍,则a、b可能是( )
A.a=1,b=4B.a=3,b=3
C.a=2,b=3D.a=3,b=2
查看答案和解析>>
科目: 来源: 题型:
【题目】Q、W、X、Y、Z 是位于不同主族的五种短周期元素,其原子序数依次增大。
①W 的氢化物与 W 最高价氧化物对应水化物反应生成化合物甲。
②X、Y、Z 的最高价氧化物对应水化物之间两两反应均可生成盐和水。
③常温下,Q 的最高价气态氧化物与化合物 X2O2 发生反应生成盐乙。
请回答下列各题:
(1)甲的水溶液呈酸性,用离子方程式表示其原因____________________________________________________________________________。
(2)③中反应的化学方程式为________________________________________________________________________________________________。
(3)已知:ZO3n-+M2++H+→Z-+M4+ + H2O(M 为金属元素,方程式未配平)由上述信息可推测 Z 在周期表中位置为________________________________________________________________________________________________。
(4)Y 形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成 NO。写出此反应的离子方秳式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com