
科目: 来源: 题型:
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 平衡常数K3
2CH3OH(g) △H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:H2(g)+I2(g) === 2HI(g) △H= -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活息息相关,下列叙述正确的是
A.次氯酸钠溶液作消毒剂,是因为钠盐能使蛋白质变性
B.工业电解熔融氧化铝冶炼铝,是因为氧化铝的成本比氯化铝低
C.生活中常用铁酱油、AD钙奶和钠盐,是因为铁、钙、碘都是人体必需元素
D.用硫化钠除去废水中的![]() 、
、![]() ,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀
,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业生产中所用的αFe催化剂的主要成为FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比4∶5,其中Fe2+与Fe3+物质的量之比为_____。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化剂活性最高,此时混合物中铁的质量分数为______(保留2位小数)。
(3)写出由C(炭粉)与Fe2O3在高温下反应制备α铁触媒的化学方程式(另一种产物可溶于水)_____。
(4)为制得这种活性最高的催化剂,理论上应向480 g Fe2O3粉末加入炭粉的质量为_____,生成实验条件下CO2的体积为_____(假设此实验条件下,气体摩尔体积为24 L·mol-1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】空气吹出法是目前“海水提溴”的主要方法之一,其工艺流程如图所示。下列说法不正确的是( )
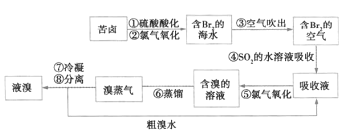
A.步骤④⑤是为了富集溴
B.步骤③说明Br2具有挥发性
C.步骤④说明Br2具有还原性
D.步骤⑧中溴蒸汽冷凝后得到液溴与溴水的混合物,可用分液漏斗将二者分离
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是

A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:ClO3- + 2H+ + e-![]() ClO2↑ + H2O
ClO2↑ + H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充44.8Lb气体(标况下)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_______形象化描述。在基态14C原子中,核外存在_______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_______。
(3)CS2分子中,共价键的类型有___,C原子的杂化轨道类型是____,写出两个与CS2具有相同空间构型和键合形式的分子或离子___。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于__晶体,1mol Fe(CO)5有σ键__NA
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
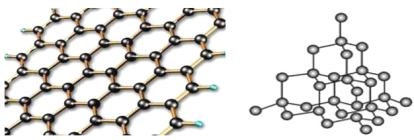
①在石墨烯晶体中,每个C原子连接___个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接__个六元环,六元环中最多有___个C原子在同一平面。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是( )
A.25 ℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6mol·L-1
B.向溶液中加入少量CH3COONa固体,溶液中的![]() 值变小
值变小
C.向溶液中加入10 mL 0.1 mol·L-1HCl,所得溶液中离子浓度大小顺序为c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.向溶液中加入5 mL 0.1 mol·L-1HCl,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体中可能合有Na+、K+、NH4+、Fe2+、Fe3+、 Cl-、SO42-、CO32-、HCO3-,将其配成100mL溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:

请回答下列问题:
(1)配制100mL该溶液的过程中,“定容”操作正确的是________________。
A.  B.
B.  C.
C.  D.
D.
通过鉴定,该固体中一定存在的阳离子是_____________,一定不存在的阴离子是_____________。可能存在的离子是______________。实验过程生成气体的反应离子方程式为___________________
(2)下列实验结论符合事实的是_____________。
A.该固体中可能含有(NH4)2SO4、K2SO4、NaCl
B.该固体中可能含有(NH4)2SO4、KCl,一定不含NH4Cl
C.该固体中一定含有NH4Cl、K2SO4
D.该固体中可能含有(NH4)2SO4、KCl
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
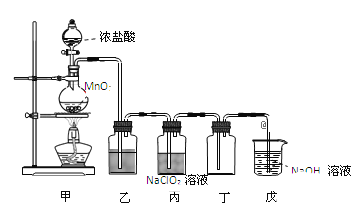
(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO![]() 、ClO
、ClO![]() ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com