
科目: 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是

A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应现象:有白烟生成XY ZW
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是
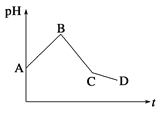
A.阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2
B.AB段阳极只产生Cl2,阴极只产生Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段相当于电解水
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式_________;
(2)与CN-互为等电子体的分子是______,K4[Fe(CN)6]中的作用力除离子键和共价键外,还有_______。含有12mol σ键的K4[Fe(CN)6]的物质的量为_______mol。
(3)黄血盐中C原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________;
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是__________;
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_____g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:t1<t2
B.t1℃ 时,该反应的平衡常数K=![]()
C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变
D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl
①该电池的负极反应式是____________;
②在电池中,Na+不断移动到“水”电池的________极(填“正”或“负”);
③外电路每通过4 mol电子时,生成Na2Mn5O10的物质的量是________;
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为_________;
②该电池负极的电极反应式_________;
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有________个电子转移。
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:_________;
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数为X最外层电子数的一半,X、Y、Z的原子半径依次减小,X、Y、Z组成的一种化合物(ZXY)2的结构式为Y≡X—Z—Z—X≡Y。下列说法正确的是
A.(XY)2中X元素的化合价为+3
B.Y的氧化物对应的水化物是强酸
C.化合物W(Y3)2中只含有离子键
D.X和Z组成的化合物中不可能所有原子都达到8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)MnO(s)+CO2(g) △H1=+a kJmol1
ii.2MnO(s)+O2(g)2MnO2(s) △H2=+b kJmol1
①反应i的化学平衡常数表达式K=_______;
②焙烧MnCO3制取MnO2的热化学方程式是_________;
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_______;

(3)在其他条件不变时,某科研团队对影响转化率的生产条件进行了研究,结果如图2、图3所示。
①常压下,要提高MnCO3的转化率,应选择的生产条件是____________焙烧6![]() 8h。
8h。
②图3中,焙烧8h时,MnCO3的转化率:干空气<湿空气,原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出NaHSO4溶液的电离方程式_____; 写出Na2CO3水解的离子方程式_____ ;
(2)25℃时,pH= a的NaOH溶液中, 溶液的C(OH-) =_____ mol/L。
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(请用相应字母填)
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是______。
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是_____。
③若三者pH相同且体积相等,中和NaOH的能力由大到小的顺序是________。
(4)有下列盐溶液:①MgCl2 ②KNO3 ③KClO ④CH3COONH4 ⑤NaCN⑥Fe2(SO4)3,呈酸性的是________,呈碱性的是________,呈中性的是________(用相应的序号填写)。
(5)请写出明矾(K Al(SO4)212H2O)做净水剂净水时的离子方程式____________;
(6)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生反应的离子方程式:____________;
(7)物质的量浓度相同的 氯化铵;②碳酸氢铵;③ 硫酸氢铵;④硫酸铵4种溶液中,c(![]() )由大到小的顺序是_____ (请用相应的序号填写)
)由大到小的顺序是_____ (请用相应的序号填写)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有0.1mol·L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大②[NH3·H2O]增大③![]() 数目增多④[OH-]增大⑤导电性增强⑥
数目增多④[OH-]增大⑤导电性增强⑥![]() 增大⑦
增大⑦![]() 减小
减小
A.①②③B.①③⑤C.①③⑥D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com