
科目: 来源: 题型:
【题目】科学家制造出一种使用固态电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作为惰性电极,在电极上分别通入CH4和空气,其中固态电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-=2O2-)。
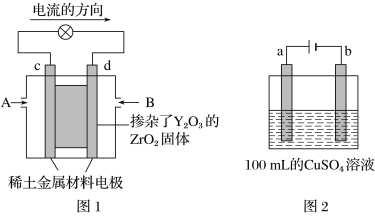
(1)c电极的名称为________(填“正极”或“负极”),d电极上的电极反应式为: ____。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为: __________,若a电极产生56 mL(标准状况)气体,则所得溶液的c(H+)=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
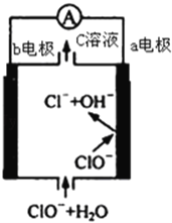
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】不同温度下,三个体积均为1L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | ||||
CH4 | NO2 | N2 | CO2 | H2O | NO2 | ||
I | T1 | 0.50 | 1.2 | 0 | 0 | 0 | 0.40 |
II | T2 | 0.30 | 0.80 | 0.20 | 0.20 | 0.40 | 0.60 |
III | T3 | 0.40 | 0.70 | 0.70 | 0.70 | 1.0 | |
A.T1<T2
B.若升高温度,正反应速率减小,逆反应速率增大,平衡逆移
C.平衡时,容器I中反应放出的热量为693.6 kJ
D.容器III中反应起始时v 正(CH4) <v逆(CH4)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,下列说法正确的是( )
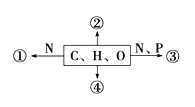
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②广泛分布在动物细胞内,则其一定是糖原
C. 若③为生物大分子,则其彻底水解产物最多为4种
D. 若④为重要储能物质,则动物和植物细胞都含有这种物质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是
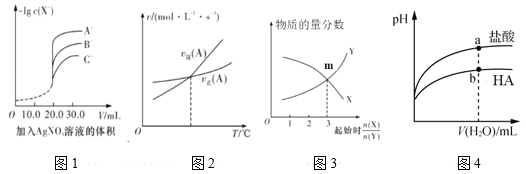
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.17g -OH(羟基)中含有的电子数为10 NA
B.1mol CH3CH3中含有的共价键数为7 NA
C.标准状况下,2.24 L苯中C-H键的数目为0.6 NA
D.5mL 0.1mol·L-1 KI溶液中加入0.1mol·L-1 FeCl3溶液1mL,充分反应后转移电子数10-4 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g) △H=-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快); 4VO2+O2→2V2O5(慢),下列说法正确的是( )
2SO3(g) △H=-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快); 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A.反应速率主要取决于V2O5的质量B.VO2是该反应的催化剂
C.该反应逆反应的活化能大于198kJ/molD.升高温度,该反应的△H增大
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
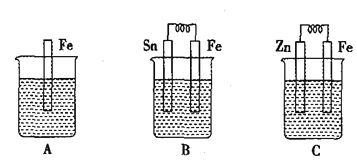
①B中Sn极的电极反应式为__________,Sn极附近溶液的pH_____(填“增大”、“减小”或“不变”)。
②C中总反应离子方程式为_____________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是______(填“a”或“b”)电极,该极的电极反应是_______。
②电池工作一段时间后电解质溶液的pH____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com