
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.17g -OH(羟基)中含有的电子数为10 NA
B.1mol CH3CH3中含有的共价键数为7 NA
C.标准状况下,2.24 L苯中C-H键的数目为0.6 NA
D.5mL 0.1mol·L-1 KI溶液中加入0.1mol·L-1 FeCl3溶液1mL,充分反应后转移电子数10-4 NA
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,极易溶于水,不与水反应。若温度过高,二氧化氯的水溶液可能会发生爆炸。某研究性学习小组拟用如下图所示装置制取并收集ClO2(加热和夹持装置均省略)。

(1)在圆底烧瓶中先放入一定量的KClO3和草酸H2C2O4),然后再加入足量的稀硫酸,在60~80℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________。
(2)装置A中使用温度计的目的是____。反应开始后,可以观察到圆底烧瓶内的现象是_____。
(3)装置B的作用是________。
(4)实验过程中装置D中的溶液里除生成Na2CO3外,还生成物质的量之比为1︰1的另外两种盐,一种为NaClO3,另一种为_______。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液20mL,稀释成100mL试样,量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用 cmol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V2mL。
已知:2ClO2+8H++10I-==5I2+2C1-+4H2O 2Na2S2O3+I2=Na2S4O6+2NaI
请回答:
①配制100mL步骤3中所需的Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______。(填仪器名称)
②步骤3中滴定终点的现象为_______。
③原ClO2溶液的浓度为_______g·L-1(用含字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.显酸性的溶液是酸溶液,显碱性的溶液是碱溶液
B.盐促进水的电离,酸碱抑制水的电离
C.常温下,某溶液中水电离出的H+浓度为1×10-9 mol/L,该溶液不一定是碱溶液
D.中性溶液即pH=7的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)MnO(s)+CO2(g) △H1=+a kJmol1
ii.2MnO(s)+O2(g)2MnO2(s) △H2=+b kJmol1
①反应i的化学平衡常数表达式K=_______;
②焙烧MnCO3制取MnO2的热化学方程式是_________;
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_______;

(3)在其他条件不变时,某科研团队对影响转化率的生产条件进行了研究,结果如图2、图3所示。
①常压下,要提高MnCO3的转化率,应选择的生产条件是____________焙烧6![]() 8h。
8h。
②图3中,焙烧8h时,MnCO3的转化率:干空气<湿空气,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固态电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作为惰性电极,在电极上分别通入CH4和空气,其中固态电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-=2O2-)。
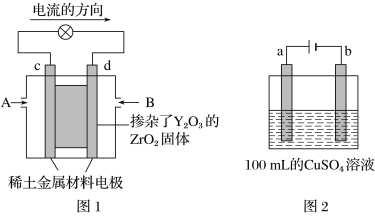
(1)c电极的名称为________(填“正极”或“负极”),d电极上的电极反应式为: ____。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为: __________,若a电极产生56 mL(标准状况)气体,则所得溶液的c(H+)=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
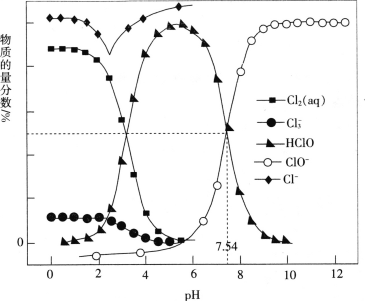
A.pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
B.氯水中的Cl2、ClO-、HClO均能与K2S发生反应
C.已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3- (aq)的K=0.191,当pH增大时,K减小
Cl3- (aq)的K=0.191,当pH增大时,K减小
D.该温度下,HClO![]() H++ClO-的电离常数Ka=10-7.54
H++ClO-的电离常数Ka=10-7.54
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究某固体化合物X(含三种元素)的组成和性质,设计并完成如下实验,其中气体C能使带火星的木条复燃。
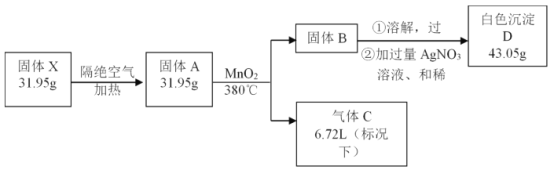
请回答:
(1)白色沉淀D是_______。
(2)固体A中物质生成B和C的化学方程式为__________________。
(3)X的化学式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com