
【题目】下列说法中正确的是( )
A.显酸性的溶液是酸溶液,显碱性的溶液是碱溶液
B.盐促进水的电离,酸碱抑制水的电离
C.常温下,某溶液中水电离出的H+浓度为1×10-9 mol/L,该溶液不一定是碱溶液
D.中性溶液即pH=7的溶液
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
实验编号 试剂 | A | B | C |
10% H2O2/mL | 20.0 | V1 | V2 |
2 mol·L-1 FeCl3/ mL | 0 | 5.0 | 10.0 |
H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用图装置来比较该反应的反应速率快慢,检查该装置气密性的方法是_______。

(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测____________________推(计)算反应速率。
(3)为实现实验目的,则V4=____。
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 =2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:___________________。
(5)读数时发现,量气装置左端液面低于右端液面,则测得的气体体积_____填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molNa2O2与SO2完全反应,转移2NA个电子
B. 标准状况下,11.2L乙醇中含有的极性共价键数目为3.5NA
C. 18g的D2O中含有的中子数为10NA
D. 1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:Ca2+ +OH + HCO3 = CaCO3↓+ H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:SO2+H2O+Ba2+ = BaSO3↓+ 2H+
C.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O2
+CO2+H2O2![]() +CO32
+CO32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,请回答下列问题:
常温下,某Na2CO3溶液中滴入酚酞,溶液呈_____色,则该溶液呈 ______ 性,原因是 ______(用离子方程式表示),若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是_________,
(2)已知在H2S溶液中存在下列平衡:H2S![]() HS- + H+
HS- + H+
①向H2S溶液中加入NaOH固体时(不考虑温度变化),电离平衡向 ______ 移动(填“左”或“右”)![]() ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
②向H2S溶液中加入NaHS固体时,电离平衡向______ 移动(填“左”或“右”),pH ______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4= FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A_______B_______(填“能”或“不能”)
(2)根据下图填空

①负极为___________,该电极的方程式为__________________
②正极的现象是________________________________,发生____________________反应(填写“氧化”或“还原”)
③电子从_____经导线流向_______,溶液中H+向________移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)B装置的作用是________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有______气体产生,写出D中发生反应的离子方程式____________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体分解后产生NH3,写出其两种用途________________________________________。
(4)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请完成表内容。(试剂,仪器自选)
实验步骤 | 预期现象 | 结论 |
①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解; ②______________________________________________________ | 固体残留物仅为Fe2O3 |
(5) 用实验的方法验证C溶液含有NH4+___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.17g -OH(羟基)中含有的电子数为10 NA
B.1mol CH3CH3中含有的共价键数为7 NA
C.标准状况下,2.24 L苯中C-H键的数目为0.6 NA
D.5mL 0.1mol·L-1 KI溶液中加入0.1mol·L-1 FeCl3溶液1mL,充分反应后转移电子数10-4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素P的结构如图所示,其中R为烷烃基。下列关于维生素P的叙述正确的是
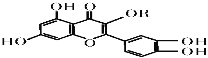
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为甲基,则该物质的分子式可以表示为C16H12O7
C.1 mol该化合物最多可消耗NaOH 为5mol
D.1 mol该化合物最多消耗溴水中的溴5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com