
科目: 来源: 题型:
【题目】下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法正确的是
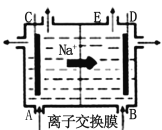
A.从E口逸出的气体是 Cl2
B.每生成 22.4 L Cl2,同时产生2 mol NaOH
C.从B口加入含少量NaOH的水溶液以增强导电性
D.依次用Na2CO3、NaOH、BaCl2、盐酸等试剂除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知t℃时AgCl的Ksp=2×10-10;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
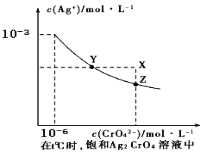
A. 在t℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D. 在t℃时,AgCl的溶解度大于Ag2CrO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示装置的叙述,正确的是( )
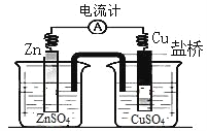
A.铜做正极,铜片上有气泡产生
B.盐桥中的阴离子会移向 CuSO4 溶液
C.正极附近的 SO![]() 浓度逐渐增大
浓度逐渐增大
D.锌片表面被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3具有广泛的用途。实验室常用如图所示装置制取并收集NH3。

(1)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为______。
(2)干燥NH3应选用的干燥剂是______。
(3)图1中方框内收集NH3的装置可选用图2中的______(填序号)。
(4)尾气处理装置中使用倒置漏斗的作用是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
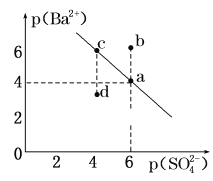
A.加入BaCl2可以使溶液由c点变到a点
B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C.d点表示的是该温度下BaSO4的不饱和溶液
D.该温度下,Ksp(BaSO4)=1.0×10-24
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,九种短周期元素![]() 用字母表示
用字母表示![]() 原子半径的相对大小、最高正价或最低负价的变化如图所示.
原子半径的相对大小、最高正价或最低负价的变化如图所示.

请回答下列问题;
![]() 、d、e、f四种元素的简单离子中,半径最大的离子是 ______
、d、e、f四种元素的简单离子中,半径最大的离子是 ______ ![]() 填离子符号
填离子符号![]()
![]() 的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
![]() 含f元素的两种离子在溶液中不能大量共存的原因是 ______
含f元素的两种离子在溶液中不能大量共存的原因是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
![]() 关于图乙所示转化关系
关于图乙所示转化关系![]() 代表卤素
代表卤素![]() ,下列说法错误的是 ______ 。
,下列说法错误的是 ______ 。
A.![]()
B.![]()
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
![]() 元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:![]() 制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
A.钠与水反应制氢气 ![]() 过氧化钠与水反应制氧气
过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸 ![]() 氟单质与水反应制氧气
氟单质与水反应制氧气
![]() ,f的最高价氧化物的水化物的
,f的最高价氧化物的水化物的![]() ,使含
,使含![]() 的离子的溶液开始产生沉淀的pH为 ______ 。
的离子的溶液开始产生沉淀的pH为 ______ 。
![]() 元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、Q是原子序数依次增大的前四周期元素。W是宇宙中最丰富的元素;X、Z 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
(1)第一电离能 Y ________________ Z,电负性 Y ________________ Z(填“大于”、“小于”或“等于”)。
(2)写出与XZ分子互为等电子体的一种离子的化学式________________。
(3)若向含有Q2+ 的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有_____________色晶体析出,该晶体中,中心离子的电子排布式为________________,配体为________________。
(4)已知 W 、 Y 形成的一组二元化合物化学式:![]() 、
、![]() 、
、![]() 、
、![]() 其中,
其中,![]() 分子中 Y 原子的杂化类型为________________;这组化合物的通式为________________。W、Y 形成的化合物的种类比 W、X 形成的化合物的种类________________ 填“多”或“少”。
分子中 Y 原子的杂化类型为________________;这组化合物的通式为________________。W、Y 形成的化合物的种类比 W、X 形成的化合物的种类________________ 填“多”或“少”。
(5)Q单质的晶体属于面心立方最密堆积。已知 Q 单质的密度是 ![]() ,NA表示阿伏加德罗常数的值,Q 的相对原子质量为 M,则 Q 晶体中最邻近的原子核间距为________________ cm 用含 M、d、NA 的代数式表示 。Q原子在晶胞中的空间利用率为________________(用含N的代数式表示)。
,NA表示阿伏加德罗常数的值,Q 的相对原子质量为 M,则 Q 晶体中最邻近的原子核间距为________________ cm 用含 M、d、NA 的代数式表示 。Q原子在晶胞中的空间利用率为________________(用含N的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Bodensteins 研究了反应 2HI(g)![]() I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
A.反应物浓度越大,正反应速率越大
B.生成物浓度越大,逆反应速率越大
C.该反应的平衡常数K =k正/k逆
D.速率常数的大小与反应程度无关系
查看答案和解析>>
科目: 来源: 题型:
【题目】有 A 、 B 、 C 、 D 、 E 、 F 六种元素,已知:
① 它们位于三个不同的短周期,核电荷数依次增大。
②E元素的电离能数据见下表(KJ/mol):
![]()
③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:_______________________________
(2)B2A2 分子中存在______________ 个![]() 键,_____________个
键,_____________个![]() 键。
键。
(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键 | F—D | F—F | B—B | F—B | B=D | D=D |
键能(KJ/mol) | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
试计算1molF单质完全燃烧时的反应热△H=________(已知1molF单质中含2mol F—F键,1molFO2中含有4mol键F—O)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X Y Z |
初始浓度/mol·L-1 | 0.1 0.2 0 |
平衡浓度/mol·L-1 | 0.05 0.05 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z
2Z
C.平衡常数 K = 1600 mol-2·L2
D.增大压强和升高温度,平衡正方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com