
科目: 来源: 题型:
【题目】下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】传统的生物脱氮主要包括有氧条件下的硝化反应过程和缺氧环境下的反硝化反应过程,其工艺如下图所示。硝化过程中,![]() 先后被氧化为
先后被氧化为![]() 和
和![]() 。
。![]() 硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的
硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的![]() 和
和![]() 还原为N2,如:5CH3OH +6
还原为N2,如:5CH3OH +6![]() = 3N2↑+5CO2+7H2O+6OH-
= 3N2↑+5CO2+7H2O+6OH-
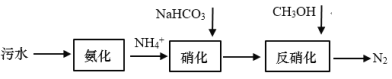
(1)请写出![]() 硝化生成
硝化生成![]() 的离子方程式:________。
的离子方程式:________。
(2)若1mol![]() 继续被氧化为
继续被氧化为![]() ,需消耗O2____L。(标准状况)
,需消耗O2____L。(标准状况)
(3)现在很多国家采用半硝化工艺(ANAMMOX) ,工作原理如下图所示:
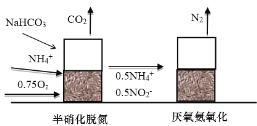
①写出厌氧氨氧化时![]() 与
与![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
②若采用该方法,请判断是否需要加入碳源(甲醇),并简述理由______。
(4)研究发现,脱氮工艺常会产生一种温室气体N2O,目前普遍认为形成于硝化阶段,则生成N2O的可能原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④![]() 的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类
⑦干冰晶体中,一个![]() 分子周围有12个
分子周围有12个![]() 分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
A.①②③⑥B.②③④C.④⑤⑥D.②③⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列填空:
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.

(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作中,先后顺序正确的是
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.酸碱中和滴定时,锥形瓶先用标准液洗涤后,再注入待测液
C.在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
D.为检验酸性溶液中的![]() 和
和![]() ,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是( )
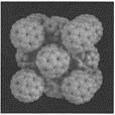
A. C60摩尔质量是720
B. C60与苯互为同素异形体
C. 在C60晶胞中有14个C60分子
D. 每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
科目: 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,![]() 废气的处理已成为研究的热点,图1是以
废气的处理已成为研究的热点,图1是以![]() 为主要原料的化工产品的生产过程。
为主要原料的化工产品的生产过程。

(1)关于侯氏制碱法,回答下列问题:
①写出![]() 的电子式______。
的电子式______。
②实验室制取![]() 的化学方程式______。
的化学方程式______。
③由侯氏制碱法获得![]() 分为两步:
分为两步:
I.![]()
II.______。
(2)尿素是重要的氮肥,请写出由![]() 生产尿素的化学方程式______。
生产尿素的化学方程式______。
(3)![]() 催化加氢制取汽油过程中发生如下反应:
催化加氢制取汽油过程中发生如下反应:
![]()
![]()
![]()
![]()
已知:在一定温度下,10L的密闭容器中,通入![]()
![]() 和
和![]()
![]() ,反应过程如图2所示,回答下列问题:
,反应过程如图2所示,回答下列问题:
①计算该温度下反应的平衡常数![]() ______。
______。
②下列可以判断该反应达到平衡状态的是______。
![]() 单位时间内,
单位时间内,![]() 的减少量等于CO的生成量
的减少量等于CO的生成量
![]() 反应容器内的压强不发生变化
反应容器内的压强不发生变化
![]() 混合气体中
混合气体中![]() 的浓度不再发生改变
的浓度不再发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是( )
A.H2(g)+1/2O2(g)![]() H2O(l)ΔH=-285.8kJ·mol-1
H2O(l)ΔH=-285.8kJ·mol-1
B.H2(g)+1/2O2(g)![]() H2O(g)ΔH=-285.8kJ·mol-1
H2O(g)ΔH=-285.8kJ·mol-1
C.2H2(g)+O2(g)![]() 2H2O(l)ΔH=-285.8kJ·mol-1
2H2O(l)ΔH=-285.8kJ·mol-1
D.H2+1/2O2![]() H2OΔH=-285.8kJ·mol-1
H2OΔH=-285.8kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
I.请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为________。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为_________(填化学式);
(3)元素①、③形成的18电子化合物的电子式为______;
(4)元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式);
(5)元素⑤、⑧的最高价氧化物对应的水化物的水溶液反应的离子方程式为_________。
II.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(6)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是__(填物质化学式)。若电解液体积为2L(
(7)甲醛(HCHO)燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为________;
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”);
③右侧电极的电极反应方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com