
科目: 来源: 题型:
【题目】由环己烷可制得1,2—环己二醇,反应过程如下:

下列说法错误的是
A. ①的反应条件是光照 B. ②的反应类型是消去反应
C. ③的反应类型是取代反应 D. ④的反应条件是NaOH、H2O加热
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验离不开水。请根据水的不同作用和功能,分析以下四个装置图,回答问题:
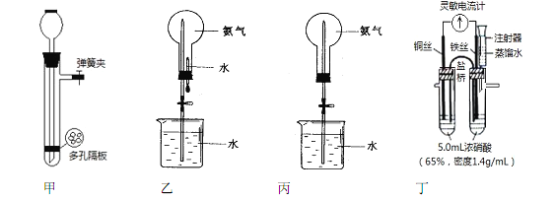
实验一:制取氢气
(1)图甲所示装置可用于实验室制取氢气,这种制气装置在加入反应物前,如何检查气密性______。
(2)用锌与稀硫酸制取氢气时,加入少量硫酸铜溶液会加快产生氢气的速率,请解释加快反应速率的原因:________________________________。
实验二:喷泉实验
(3)图乙所示装置中烧瓶已装满干燥氨气, 进行喷泉实验时应该先___________(填“挤捏胶头滴管”或“打开止水夹”)。
(4)如果只提供如图丙所示装置,若想迅速引发喷泉,下列方法可行的是____________。
a.用热毛巾捂住烧瓶
b.用冰块捂住烧瓶
c.将烧杯中的水换成饱和食盐水
d.向烧杯中加入少量硫酸
实验三:探究一定温度下能使铁钝化的硝酸的最低浓度,实验装置如图丁所示。
①开始实验时,观察到灵敏电流计指针指向铜丝,但又迅速反转指向铁丝;
②再用盛蒸馏水的注射器缓慢向具支试管内加水并振荡,在指针恰好开始反转指向铜丝时停止实验;
③重复三次实验得平均加水量为2.5 mL(水的密度按1.0g/mL计算)。
(5)该实验装置的不足之处是__________________________________。
(6)当指针第一次指向铜丝时,正极的电极反应式为_______________________________。
(7)根据此实验计算,使铁钝化的硝酸最低质量分数为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组混合物的总物质的量一定,每组中的物质以任意比例相混合,完全燃烧时消耗氧气的量不变的是
A.甲烷、甲醇和甲醛B.甲醇、甲醛和甲酸
C.乙醇、乙烯和丙烯酸D.甲酸、乙二酸和乙二醇
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Mg(OH)2(s) ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg(s)
Mg(s)
B.FeCl2(aq) ![]() FeCl3(aq)
FeCl3(aq) ![]() Fe(OH)3(胶体)
Fe(OH)3(胶体)
C.AgNO3(aq) ![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq) ![]() Ag(s)
Ag(s)
D.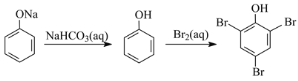
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为:![]() ,请写出此反应的热化学方程式 ______________________________。
,请写出此反应的热化学方程式 ______________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:

① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= _____________;2.00min~5.00 min内,O2的平均反应速率为 _______________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是 ______________。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) ![]() 2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
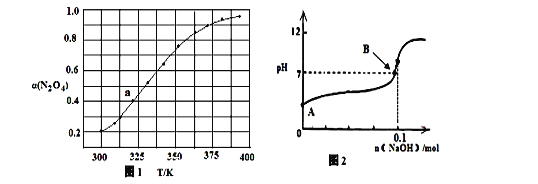
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=________(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量 ________mol(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将浸透了石蜡油的石棉放在试管中进行下列实验,请回答下列问题。
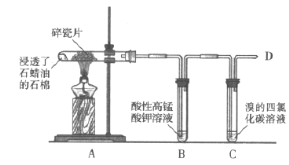
(1)反应一段时间后,B试管中的现象是___,由此说明石蜡油分解产生的气体具有___性(填“氧化”或“还原”)。
(2)若石蜡油分解产生乙烯,则C中发生反应的化学方程式是___。
(3)在D处点燃气体,观察到的现象是___。
(4)除去甲烷中混有的乙烯应采用的方法是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是![]()
A.金属钠和其他碱金属都可保存在煤油中
B.湿法冶炼是指金属在溶液中发生的置换反应,如金属钠置换出硫酸铜溶液中的铜
C.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
D.制备![]() 、
、![]() 、
、![]() 均不能采用将溶液直接蒸干的方法
均不能采用将溶液直接蒸干的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() 。
。
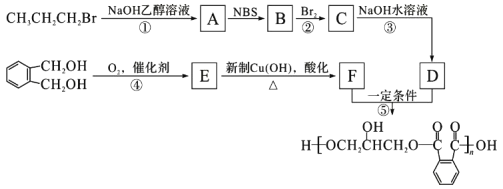
醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
(1)B中含碳官能团的结构式为________,C的名称是_________。
(2)反应①的有机反应类型是 ________。
(3)下列说法正确的是____________(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2 mol Ag
b.F能与NaHCO3反应产生CO2
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、硝酸银溶液。
(4)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有_____种。
的同分异构体中同时符合下列条件的芳香族化合物共有_____种。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(5)写出E与新制的氢氧化铜悬浊液反应的化学方程式_____________;
(6)写出反应⑤的化学方程式___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com