
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。
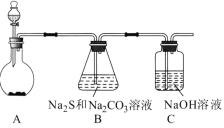
(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
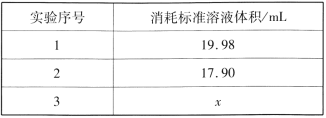
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。

查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德常数的值。下列叙述中正确的是( )
A.标准状态下,11.2LH2含有的中子数为NA
B.常温下,27gAl投入足量浓硝酸中充分反应,转移的电子数为3NA
C.一个Cu原子的质量为ag,则mg铜的物质的量为![]() mol
mol
D.含2molCH3COO-的CH3COONa溶液中Na+的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望运用于未来的运载火箭和空间运输系统。实验测得101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ的热量;1molCH4完全燃烧生成液态水和CO2,放出890.3kJ的热量。下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)=2H2O(l) ΔH=+285.8kJmol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJmol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJmol-1
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)其归纳正确的是( )
①反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1。
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度均降低。
⑤在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系:c(NH4+)+2c(H+)=2c(OH-)+c(NH3·H2O)
⑥反应A(g)![]() 2B(g)△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则 △H =(Ea -Eb)kJ·mol-1。
2B(g)△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则 △H =(Ea -Eb)kJ·mol-1。
A. 全部 B. ②④⑤⑥ C. ①③④⑥ D. ①③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
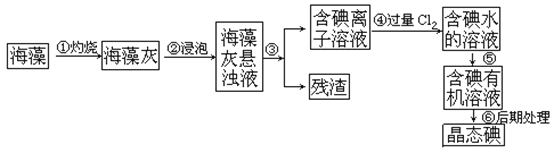
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③______,步骤⑤______。
(2)写出步骤④对应反应的离子方程式:______________________________。
(3)提取碘的过程中,可供选择的有机试剂是_______________。
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,尚缺少的玻璃仪器是_________________________________________________________。
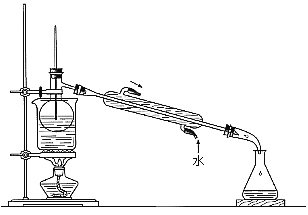
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A.充电时,当阳极质量减少23.9g时转移0.2 mol电子
B.放电时,PbO2电极附近溶液的pH增大
C.电子放电时,负极反应为PbO2+4HBF4-2e-=Pb(BF4)2+2HF4-+2H2O
D.充电时,Pb电极的电极反应式为PbO2+H++2e-=Pb2++2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3 mol/L H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3,减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4,将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为__________________________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________________________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇 B.饱和K2SO4溶液 C.蒸馏水 D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL 1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00 mL溶液干250 mL锥形瓶中,加入30 mL 0.10mol/L EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20 mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00 mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+,H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为_________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:_______
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=![]() ×100%):
×100%):
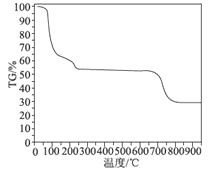
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:___________、_____________
查看答案和解析>>
科目: 来源: 题型:
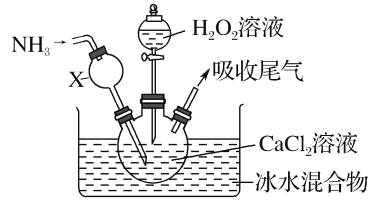
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,雾霾天气成为我国华北地区乃至全国的环境问题之一。
Ⅰ汽车尾气是空气污染的重要原因。汽车尾气净化原理为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H <0。
2CO2(g)+N2(g) △H <0。
(1)该反应的平衡常数表达式为____________________。
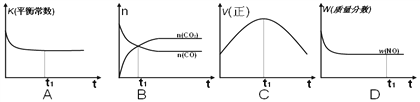
(2)在一恒容的绝热容器(不与外界发生热交换)中模拟上述反应。下面各示意图正确且能说明反应在t1时刻达到平衡状态的是__________。
Ⅱ煤燃烧产生的烟气中含有大量硫、氮的氧化物,会引起严重的环境污染问题。
(1) 硫、氮的氧化物都会形成酸雨。为减少酸雨产生,下列措施中不可行的有_______(填序号)。
a.少用煤作燃料 b.把工厂的烟囱加高 c.燃料脱硫
d.燃煤时鼓入足量空气 e.开发新能源
(2)煤燃烧产生的氮的氧化物可以用CH4催化还原。已知:
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) △H =-867kJ/mol
2NO2(g) = N2O4(g) △H =-56.9kJ/mol
H2O(l) = H2O(g) △H =+44kJ/mol
写出CH4(g) 还原N2O4(g)生成N2(g) 、CO2(g)和H2O(l)的热化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
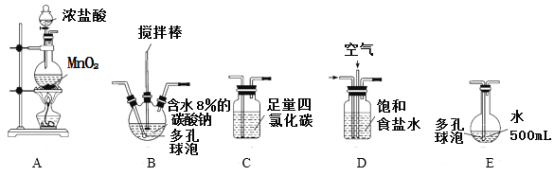
(装置及实验)用以下装置制备次氯酸溶液。
回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置A中反应的离子方程式是__________________________。
(3)实验中控制氯气与空气体积比的方法是_____________________。
(4)反应过程中,装置B需放在冷水中,其目的是_________________________。
(5)装置E采用棕色圆底烧瓶是因为______________________。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为_________g。
(7)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用________________准确量取20.00 mL次氯酸溶液,加入足量的________溶液,再加入足量的________溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com