
科目: 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
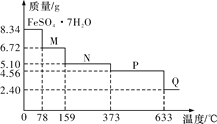
A. 温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B. 取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4
C. 在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D. 温度为159 ℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 0.2 mol·L-1与0.1 mol·L-1 HClO溶液中c(H+)之比为2:1
B. pH=2和pH=1的硝酸中c(H+)之比为1:2
C. 25 ℃时,0.1 mol·L-1CH3COOH的电离平衡常数K=2×10-5,则0.1 mol·L-1CH3COONa的水解平衡常数为5×10-10
D. 0.1 mol·L-1NaHCO3溶液中:c (Na+)+ c (H+)+ c (H2CO3)<c (HCO3-) +3 c (CO32-) + c (OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】中华文化源远流长,如![]() 本草图经
本草图经![]() 中曾有对青矾的描述:“形似朴硝
中曾有对青矾的描述:“形似朴硝![]() 而绿色,取此物置于铁板上,聚碳,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金升者是真也。”对于文中描述,下列说法正确的是
而绿色,取此物置于铁板上,聚碳,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金升者是真也。”对于文中描述,下列说法正确的是![]()
![]()
A.朴硝既不属于电解质也不属于非电解质
B.青矾的成分为![]()
C.文中使用了蒸发结晶的分离方法
D.文中的反应涉及了氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.反应CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
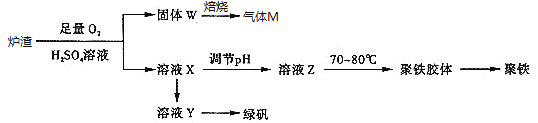
A. 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目: 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
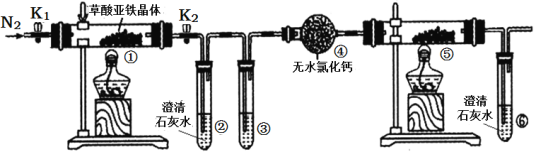
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目: 来源: 题型:
【题目】容积固定为3L的某密闭容器中加入1mol A、2mol B,一定温度下发生如下发应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
A. 5 min 内D的平均反应速率为0.02 mol·L-1·min-1
B. 第5min时C的反应速率为0.06 mol·L-1·min-1
C. 经5min后,向容器内再加入A,正反应速率变大
D. 平衡状态时,生成1molD时同时生成1molA
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。下列叙述错误的是( )
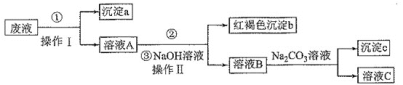
A.沉淀a中含有的单质是Cu、Fe
B.②的离子方程式是Fe2++H2O2+H+=Fe3++2H2O
C.操作Ⅱ用到的主要玻璃仪器有烧杯、漏斗、玻璃棒
D.溶液B中含有的阳离子主要是Ba2+、Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO(OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是___。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
a | 7.0 | 8.0 | 9.0 |
FeO(OH)的产率 | <50% | 95% | >95% |
FeO(OH)生成后pH | 接近4 | 接近4 | 接近4 |
用离子方程式解释FeO(OH)生成后溶液pH下降的原因:___。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO(OH)向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeO(OH)向Fe2O3的转化。
①分析,假设i不成立的实验依据是___。
②其他条件相同时,向FeO(OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如表:
c(Fe2+)/molL-1 | FeO(OH)百分含量/% | Fe2O3百分含量/% |
0.00 | 100 | 0 |
0.01 | 40 | 60 |
0.02 | 0 | 100 |
以上结果表明:___。
(3)a=7和a=9时,FeO(OH)产率差异很大的原因是___。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO(OH)红棕色悬浊液中同时加入FeSO4溶波和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3
(4)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___。
②已知N=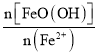 ,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
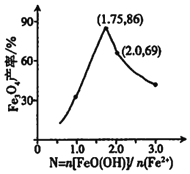
经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com