
����Ŀ������Fe3O4�ڴ����塢������ҽѧ��������й�����Ӧ��ǰ���������������Ʊ�����Fe3O4�ķ������£�
��.Fe2+����������FeSO4��Һ��NaOH��Һ����pH��a���ټ���H2O2��Һ�������õ�FeO(OH)����ɫ����Һ��
(1)������NaOH��Һ����pH��������Ұ�ɫ�������÷�Ӧ�����ӷ���ʽ��___��
��������Ӧ��ɺ��aֵ��FeO(OH)���ʼ������ɺ���ҺpH�Ĺ�ϵ��������£�
a | 7.0 | 8.0 | 9.0 |
FeO(OH)�IJ��� | <50% | 95% | >95% |
FeO(OH)���ɺ�pH | �ӽ�4 | �ӽ�4 | �ӽ�4 |
�����ӷ���ʽ����FeO(OH)���ɺ���ҺpH�½���ԭ��___��
(2)�����飺��a=7ʱ�������д��ڴ���Fe2O3����Fe2O3�IJ���������ּ��裺
i.��Ӧ��������Һ������ǿ������FeO(OH)��Fe2O3��ת����
ii.��Һ�д�������Fe2+������FeO(OH)��Fe2O3��ת����
�ٷ���������i��������ʵ��������___��
������������ͬʱ����FeO(OH)��Һ�м��벻ͬŨ��Fe2+��30 min��ⶨ���ʵ���ɣ���������
c(Fe2+)/molL-1 | FeO(OH)�ٷֺ���/% | Fe2O3�ٷֺ���/% |
0.00 | 100 | 0 |
0.01 | 40 | 60 |
0.02 | 0 | 100 |
���Ͻ��������___��
(3)a=7��a=9ʱ��FeO(OH)���ʲ���ܴ��ԭ����___��
��.Fe2+��Fe3+����������FeO(OH)����ɫ����Һ��ͬʱ����FeSO4�ܲ���NaOHŨ��Һ���й��������ٽ��˻��Һ���Ȼ�������ȴ�����ˡ�ϴ�ӡ�����õ�����Fe3
(4)������ʱ�ķ�Ӧ�����Բ��﴿�ȺͲ��ʵ�Ӱ�켫��
�ٹ�����pH����ʱ���ᵼ��FeSO4��Һ������������������pH����ʱ���õ�������Fe3O4�л���е�������___��
����֪N=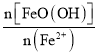 ����������һ��ʱ���������Fe3O4�IJ�����N�ı仯������ͼ��ʾ��
����������һ��ʱ���������Fe3O4�IJ�����N�ı仯������ͼ��ʾ��
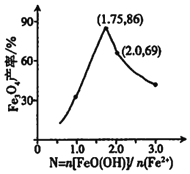
�����۷�����N=2������ʱ����Fe3O4����Ӧ��ߣ���ʵ������˵Ŀ���ԭ����___��
���𰸡�Fe2++2OH-=Fe(OH)2�� 2Fe2++4OH-+H2O2=2FeO(OH)+2H2O a=8��9ʱ��Ӧ����ҺpH���ӽ���4����Ӧ��������Һ���Ծ���ǿ ��Һ�д�������Fe2+�ɵ���FeO(OH)��Fe2O3��ת��������Һ���������Ӻ���Խ�ߣ���ͬʱ����FeO(OH)��Fe2O3��ת����Խ�� a=9ʱ��Һ�м������������ӣ���a=7ʱ��Һ�л������������� Fe2O3 ʵ�ʲ��������л��в����������ӱ���������Ϊ�����ӣ���N=2ʱ�����빲�������������Ӽ��٣��������ɵ�Fe3O4�IJ��ʼ�С
��������
��(1)������NaOH��Һ����pH��������Ұ�ɫ�������������ӽ��������������������������������
��FeSO4��Һ��NaOH��Һ����pH��a���ټ���H2O2��Һ�������õ�FeO(OH)����ɫ����Һ���������������ӣ�
(2)��ͼ�����ݷ�����pH=7��8��9 ʱFeO(OH)���ɺ�pH���ӽ���4��
������������ͬʱ����FeO(OH)��Һ�м��벻ͬŨ��Fe2+��Ũ��Խ��ᵼ��FeO(OH)Խ��Fe2O3��ת����
(3)a=7��a=9ʱ��FeO(OH)���ʲ���ܴͺ����������Ӷ����йأ�
��(4)�ٷ�Ӧ��������Һ������ǿ������FeO(OH)��Fe2O3��ת����
�ھ����۷�����N=2������ʱ����Fe3O4����Ӧ��ߣ�ͼ����N=1.75��ߣ��������������ӱ����������������������١�
I.(1)������NaOH��Һ����pH��������Ұ�ɫ�������������ӽ����������������������������������Ӧ�����ӷ���ʽ��Fe2++2OH-=Fe(OH)2����
��FeSO4��Һ��NaOH��Һ����pH��a���ټ���H2O2��Һ�������õ�FeO(OH)����ɫ����Һ���������������ӣ���ҺpH���ͣ���Ӧ�����ӷ���ʽΪ��2Fe2++4OH-+H2O2=2FeO(OH)+2H2O��
(2)��a=8��9ʱ��Ӧ����ҺpH���ӽ���4����Ӧ��������Һ���Ծ���ǿ��˵������i.��Ӧ��������Һ������ǿ������FeO(OH)��Fe2O3��ת������ȷ��
�ڱ������ݷ�����֪������������ͬʱ����Һ�д�������Fe2+�ɵ���FeO(OH)��Fe2O3��ת��������Һ���������Ӻ���Խ�ߣ���ͬʱ����FeO(OH)��Fe2O3��ת����Խ�ࣻ
(3)a=7��a=9ʱ��FeO(OH)���ʲ���ܴ��ԭ���ǣ�a=9ʱ��Һ�м�����Fe2+����a=7ʱ��Һ�л�����Fe2+��
II.(4)�ٷ�Ӧ��������Һ������ǿ������FeO(OH)��Fe2O3��ת�������Թ�����pH����ʱ���õ�������Fe3O4�л���е�������Fe2O3��
�ھ����۷�����N=2������ʱ����Fe3O4����Ӧ��ߣ���ʵ������˵Ŀ���ԭ���ǣ�ʵ�ʲ��������л��в����������ӱ���������Ϊ�����ӣ���N=2ʱ�����빲�������������Ӽ��٣��������ɵ�Fe3O4�IJ��ʼ�С��


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧԺԺʿ���������������ֲⶨ������49In����9��Ԫ�����ԭ����������ֵ��������Ϊ�����±�����֪����������13Al��ͬ���塣����˵��������ǣ�������
A.In�Ľ����Դ���Al
B.In�������2�������ĵ���
C.![]() In��������Ϊ66
In��������Ϊ66
D.![]() Inԭ�ӵ����ԭ������Ϊ115
Inԭ�ӵ����ԭ������Ϊ115
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƽ��仯�����ڹ�ҵ�ϡ����������Ϻ�ҽҩ����;�ܴش���������
(1)��̬Caԭ��M�ܲ���_____���˶�״̬��ͬ�ĵ��ӣ�Ca�ĵ�һ������__________(��������������С����)Ga��
(2)Mn��Ca����ͬһ���ڣ��Һ����������ӹ�����ͬ��������Mn���۵�е�ȶ��Ƚ���Ca�ߣ�ԭ����____________________��
(3)��������ʯ�ҷ�Ӧ��Ư��ʱ�����ɸ�����Ca(ClO3)2��Ca(ClO3)2�е������ӿռ乹����__________������ԭ�ӵ��ӻ���ʽΪ___________��
(4)̼���ε��ȷֽ�ʾ��ͼ��ͼ��ʾ

�ȷֽ��¶ȣ�CaCO3_______ (��������������������)SrCO3��ԭ����_____________________________���Ӽۼ��������CO2�����ڵĻ�ѧ��������__________��
(5)өʯ��Ψһһ�ֿ�������������Ԫ�صĿ��������ͼ��ʾ��Ca2+����λ��Ϊ__________��өʯ��һ��������������Ϊ__________����֪��������Ϊ0.545nm�������ӵ�������ֵΪNA����өʯ���ܶ�Ϊ__________g��cm��3(�г�����ʽ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���У�a��b���Ƕ��Ե缫��ͨ��һ��ʱ���a��������Һ�ʺ�ɫ.

��1����Դ�ĸ�����_____��B�е�������_____��
��2���缫�������ӵ���_____��A��Һ��pH_____���������С�����䡱����
��3��Bװ����U�ιܵ�ԭ����_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ�������ȷ������Ź㷺��;��
(1)��ѧ����������������أ�K2FeO4�����ù���Fe2O3��KNO3��KOH��ϼ��������Ϻ�ɫ������غ�KNO2�Ȳ���˷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_____________��
(2)��ҵ��ʪ���Ʊ�������أ�K2FeO4���Ĺ�����ͼ��ʾ��

����Ӧ���Ļ�ѧ����ʽΪ_________________________________________________��
����Ӧ�������ӷ���ʽΪ_________________________________________________��
�����뱥��KOH��Һ��Ŀ����_________________________________________________��
�����������һ�������ˮ���������䴦��ˮ��ԭ��Ϊ____________________________��
��ʵ��������Fe��NO3��3��Һ��Ϊ��ֹ���ֻ��ǣ�һ���ǽ�Fe��NO3��3��������ϡHNO3���ټ�ˮϡ�͡���֪25 ��ʱ��Ksp[Fe��OH��3]��4��10-38�����¶�����ʵ����������100 mL 5 mol��L-1 Fe��NO3��3��Һ����������Ҫ________mL��4 mol��L-1 HNO3��

(3)�������ƣ�Na2FeO4���Ʊ��ɲ�������Ĥ��⼼����װ����ͼ��ʾ�������ĵ缫��ӦʽΪ________�����������ҵõ���A��Һ�����ʵ���Ҫ�ɷ�Ϊ________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ��������᳧¯������Ҫ�ɷ�Ϊ���������P����FeS��SiO2�ȣ��Ʊ��������̷���FeSO47H2O���������Ļ�ѧʽΪ[Fe2(OH)n(SO4)3��0.5n]m���Ʊ�������ͼ��ʾ������˵������ȷ����
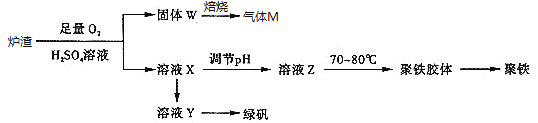
A. ¯����FeS������������ķ�Ӧ�����ӷ���ʽΪ��4FeS+3O2+12H+��4Fe3++4S��+6H2O
B. ����M�ijɷ���SO2��ͨ��˫��ˮ�õ����ᣬ��ѭ��ʹ��
C. ����ҺX�м���������ۣ���ַ�Ӧ����˵õ���ҺY���پ�����Ũ������ȴ�ᾧ�����˵Ȳ���õ��̷�
D. ��ҺZ��pHӰ�������������������������pHƫС�������¾�����������������ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;������(Ni)�������缫���ŨNaOH��Һ�Ʊ���������(Na2FeO4)��װ������ͼ��ʾ������˵����ȷ����

A�������������缫��ӦΪFe��2e����2OH��![]() Fe(OH)2
Fe(OH)2
B�����һ��ʱ������缫������Һ��pH��С
C�������ӽ���ĤΪ�����ӽ���Ĥ����������������Һ�к���FeO42��
D��ÿ�Ƶ�1mol Na2FeO4�������Ͽ��Բ���67.2L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶�ʱ����n mol��L��1��ˮ����10 mL 1.0 mol��L��1�����У���ҺpH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ����
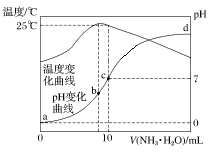
A.a��Kw��1.0��10��14
B.25 ��ʱNH4Clˮ�ⳣ��Ϊ(n��1)��10��7 mol��L��1
C.b�㣺c(NH4+)>c(Cl��)>c(H��)>c(OH��)
D.ˮ�ĵ���̶ȣ�b>c>a>d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У��������ͼ�������
A | B | C | D |
�������е���NaAlO2��Һ | NaHSO4��Һ����μ��� | ��ͭ�ۼ��뵽һ����Ũ������ | �����ۼ��뵽һ�����Ȼ�����Һ�� |
|
|
|
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com