
【题目】中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。已知:铟与铝(13Al)同主族。下列说法错误的是( )
A.In的金属性大于Al
B.In最外层有2种能量的电子
C.![]() In的中子数为66
In的中子数为66
D.![]() In原子的相对原子质量为115
In原子的相对原子质量为115
【答案】D
【解析】
A、同一主族元素的金属性随着原子序数的增大而增强;
B、铟与铝(13Al)同主族,则In的最外层电子数为3,排布在s、p轨道上;
C、中子数=质量数-质子数,据此计算判断;
D、![]() 的质量数为115。
的质量数为115。
A、铟与铝(13Al)同主族,并且铟元素的原子序数较大,同主族从上至下金属性逐渐增加,所以In的金属性强,故A不符合题意;
B、In的最外层电子数为3,排布在5s、5p轨道上,5s能级上两个电子能量相同,但小于5p能级上的电子能量,所以In最外层有2种能量的电子,故B不符合题意;
C、![]() 的质量数为115、质子数为49,所以中子数=119-49=66,故C不符合题意;
的质量数为115、质子数为49,所以中子数=119-49=66,故C不符合题意;
D、![]() 的质量数为115,In的相对原子质量为天然存在的核素In的质量数与其丰度的乘积之和,故D符合题意;
的质量数为115,In的相对原子质量为天然存在的核素In的质量数与其丰度的乘积之和,故D符合题意;
故选:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g) → CH4(g)+ C2H2(g) + H2(g) △H1= +156.6 kJ/mol
②C3H6(g) → CH4(g) + C2H2(g ) △H2= +32.4 kJ/mol
则相同条件下,反应C3H8(g) → C3H6(g) + H2(g)的△H=________kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是KOH溶液。则燃料电池的负极反应式为_________________。
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则该溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”、“<”),原因是_____________(用离子方程式和必要的文字说明)。
(4)常温下,请写出0.1 mol/LNa2CO3溶液中的各离子浓度大小关系式:_______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z为短周期主族元素,在周期表中的相应位置如图所示,下列说法不正确的是( )

A.若X为金属元素,则其与氧元素形成的化合物中阴阳离子个数比可能是1∶2
B.若Z、Y能形成气态氢化物,则稳定性一定是ZHn>YHn
C.若Y是金属元素,则其氢氧化物既能和强酸反应又能和强碱反应
D.三种元素的原子半径:r(X)>r(Y)>r(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A.X是电源的负极
B.阴、阳两极生成的气体的物质的量之比是1∶1
C.总反应可表示为H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴极的电极反应式是H2O+2e-=H2+O2-、CO2+2e-=CO+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2 可以被NaOH溶液捕获,其基本过程如下图所示(部分条件及物质未标出)。
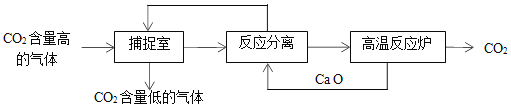
(1)下列有关该方法的叙述中正确的是______。
a.能耗大是该方法的一大缺点
b.整个过程中,只有一种物质可以循环利用
c.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
d.该方法可减少碳排放,捕捉到的 CO2还可用来制备各种化工产品
(2)若所得溶液 pH=13,CO2 主要转化为______(写离子符号)。已知 CS2与 CO2分子结构相似, CS2的电子式是______,CS2熔点高于 CO2,其原因是______。
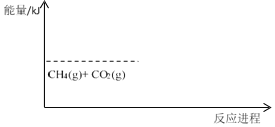
(3)CO2 与 CH4 经催化重整,制得合成气:CH4(g)+CO2(g)→2CO(g)+2H2(g)-120kJ,补全下图中 CO2 与 CH4 催化重整反应的能量变化示意图(即,注明生成物能量的大致位置及反应热效应数值)_______________
(4)常温下,在 2L 密闭容器中,下列能说明该反应达到平衡状态的是______。
a.每消耗 16gCH4 的同时生成 4gH2
b.容器中气体的压强不再改变
c.混和气体的平均相对分子质量不发生改变
d.容器中气体的密度不再改变
反应进行到 10 min 时,CO2 的质量减少了 8.8 g,则 0~10 min 内一氧化碳的反应速率是______。
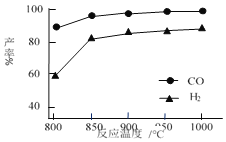
(5)按一定体积比加入 CH4 和 CO2,在恒压下发生反应,温度对 CO 和 H2 产率的影响如图所示。此反应优选温度为 900℃的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂以食盐等为原料,生产烧碱、盐酸等化工产品。工艺流程可简单表示如图:
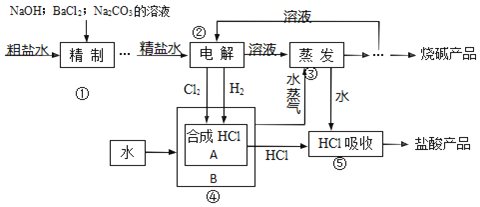
完成下列填空:
(1)粗盐水中含有 MgCl2、CaCl2、Na2SO4 等可溶性杂质,①步骤必须先后加入稍过量的 NaOH、BaCl2、Na2CO3溶液后过滤除杂。试写出加入 Na2CO3溶液时发生反应的离子方程式:______。写出②步骤发生反应的化学方程式:______。
(2)③步骤之后获得干燥的烧碱产品的有关操作有______。进行④步骤的生产设备 A、B之间传递的是(选填编号)______。
A.只有物料
B.既有物料又有能量
C.只有能量
D.既无物料也无能量
(3)如果用下列装置在实验室进行⑤步骤的实验,正确的是(选填编号)______。

若检验烧碱产品中是否含有少量 NaCl 杂质的实验方案是______。
(4)为测定烧碱产品的纯度,准确称取 5.000g 样品(杂质不含碱性物质)置于烧杯中,加水搅拌,冷却至室温后,将溶液全部转移入 1000mL 的容量瓶之后的一步操作是______。从所配得的溶液中每次都取出 20.00mL,用 0.12mol/L的盐酸滴定(选用常用指示剂),两次分别用去盐酸溶液19.81mL 和 19.79mL.判断滴定终点的依据是______,根据实验数据计算此烧碱产品的纯度为(保留两位小数)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO(OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是___。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
a | 7.0 | 8.0 | 9.0 |
FeO(OH)的产率 | <50% | 95% | >95% |
FeO(OH)生成后pH | 接近4 | 接近4 | 接近4 |
用离子方程式解释FeO(OH)生成后溶液pH下降的原因:___。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO(OH)向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeO(OH)向Fe2O3的转化。
①分析,假设i不成立的实验依据是___。
②其他条件相同时,向FeO(OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如表:
c(Fe2+)/molL-1 | FeO(OH)百分含量/% | Fe2O3百分含量/% |
0.00 | 100 | 0 |
0.01 | 40 | 60 |
0.02 | 0 | 100 |
以上结果表明:___。
(3)a=7和a=9时,FeO(OH)产率差异很大的原因是___。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO(OH)红棕色悬浊液中同时加入FeSO4溶波和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3
(4)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___。
②已知N=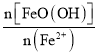 ,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
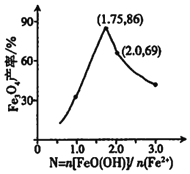
经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com