
科目: 来源: 题型:
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A.0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B.将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为![]()
C.pH加和为12的强酸与弱酸混合,pH可能为6
D.0.1mol·L-1 NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S)
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
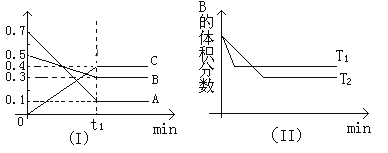
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+10)min时,保持压强不变,通入稀有气体,平衡逆反应方向移动
C.T℃时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是( )
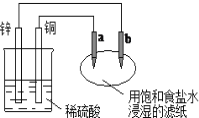
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
A. 汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-=PbSO4+4H++SO42-
B. 利用Na2CO3溶液可除油污:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. BaSO4的水溶液导电性极弱: BaSO4![]() Ba2++SO42-
Ba2++SO42-
D. 用醋酸除去暖瓶中的水垢:2H++ CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是

A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D四种物质都是气体,现在5L的密闭容器中进行反应:4A+5B![]() 4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( )
4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( )
A.反应开始至30s,v(A)=0.010mol·L-1·s-1
B.30s时容器中D的物质的量至少为0.45mol
C.30s时容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6
D.反应开始至30s,容器中A的物质的量增加了0.30mol
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示的实验,探究由两种元素组成的某未知无机矿物甲:

下列叙述错误的是( )
A.硫氰化钾的电子式为![]()
B.甲的化学式为Fe5O7
C.丙中滴加稀硝酸没有气体逸出
D.丙中滴加K3[Fe(CN)6]产生蓝色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】古埃及人在公元前一千多年前曾用橄榄石(硅酸盐)作饰品,称它为“太阳的宝石”。某小组以某橄榄石(主要成分可看作为MgO、FeO和SiO2,还含有少量的MnO等)为原料制备工业合成氨的活性催化剂(FeO和Fe2O3质量比为9:20的混合物)的一种流程如下:
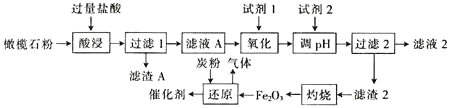
金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Mg2+ | 7.6 | 9.4 |
Fe2+ | 6.5 | 9.9 |
Fe3+ | 1.5 | 3.3 |
Mn2+ | 8.2 | 10.6 |
回答以下问题:
(1)从绿色化学角度分析,试剂1宜选择___(填字母)。加入试剂1的目的是___(用离子方程式表示)。
a.H2O2 b.MnO2 c.HNO3 d.K2Cr2O7
(2)调节pH范围为___。
(3)单位时间内“酸浸”中金属浸出率与温度、盐酸浓度的关系如图所示。
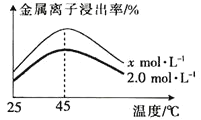
x___(填“>”“<”或“=”)2。当盐酸浓度相同时,温度高于45℃,浸出率降低的主要原因是___。
(4)“还原”过程中,不仅要控制温度,而且要控制氧化铁和炭粉(C)的比例。若“还原”时产生气体的相对分子质量为36,理论上,480kgFe2O3需要加入___kg炭粉(C)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为元素周期表的一部分,根据元素a~j在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | a | |||||||
2 | b | c | d | e | ||||
3 | f | g | h | i | j | |||
(1)f、g、h的单质分别与水反应,最剧烈的是___________(填元素符号)。
(2)c、i的氢化物稳定性较强的是____________(填化学式)。
(3)c、f可形成既含离子键又含非极性键的化合物,该化合物的电子式为__________。
(4)d、f、g的离子半径最大的是_______________(填离子符号)。
(5)f的最高价氧化物的水化物与h的最高价氧化物的水化物反应的离子方程式为:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com