
科目: 来源: 题型:
【题目】三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。
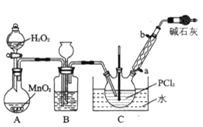
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ―112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈 水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为_______________________________;
(2)装置C中生成POCl3的化学方程式为________________________________;
(3)实验中需控制通入O2的速率,对此采取的操作是_________________________________;
(4)装置B的作用除观察O2的流速之外,还有___________________________________;
(5)反应温度应控制在60~65℃,原因是__________________________________;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是_________________________________________;
(7)测得产品中n(POCl3)= ___________________________;
(8)已知Ksp(AgCl)> Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将_______。(填偏高,偏低,或不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】磷单质及其化合物在工农业生产中有着广泛的应用。
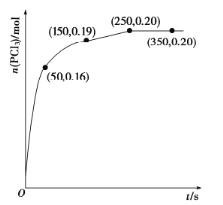
(1)温度为![]() 时,向2.0L恒容密闭容器中充入1.0 mol
时,向2.0L恒容密闭容器中充入1.0 mol ![]() ,发生反应
,发生反应![]() ,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率
,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率![]() __________,反应达到平衡后,升高温度,则
__________,反应达到平衡后,升高温度,则![]() ______(填“增大”“减小”或“不变”),再次达到平衡后,
______(填“增大”“减小”或“不变”),再次达到平衡后,![]() 的平衡浓度为
的平衡浓度为![]() ,则反应的
,则反应的![]() _____(填“>”“=”或“<”)0。
_____(填“>”“=”或“<”)0。
(2)温度为![]() 时,若平衡时体系的总压强为p,该反应的平衡常数
时,若平衡时体系的总压强为p,该反应的平衡常数![]() ______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)温度为![]() 时,上述反应若在恒压容器中进行,则达到平衡后,
时,上述反应若在恒压容器中进行,则达到平衡后,![]() 的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
(4)已知![]() 水解可生成亚磷酸
水解可生成亚磷酸![]() 。常温下,
。常温下,![]() 溶液的
溶液的![]() ,亚磷酸与足量的NaOH溶液反应生成
,亚磷酸与足量的NaOH溶液反应生成![]() ,则
,则![]() 的
的![]() 溶液中各离子浓度由大到小的顺序为_________________。
溶液中各离子浓度由大到小的顺序为_________________。
(5)亚磷酸具有强还原性,可被氧化为![]() 。
。![]() 与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。
与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。

①为获得尽可能纯的![]() ,pH应控制在_________。
,pH应控制在_________。
②已知:25℃时,![]() 的电离常数为
的电离常数为![]() ,
,![]() ,
,![]() ,则
,则![]() 时,溶液中
时,溶液中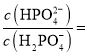 _________。
_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)3mol甲烷燃烧时,生成液态水和二氧化碳,同时放出2670.9kJ的热量,写出该反应的热化学方程式___。
(2)当1g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:___。
(3)HCl和NaOH反应的中和热ΔH= -57.3kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式:___。
(4)2g H2完全燃烧生成液态水,放出285.8kJ热量,写出该反应的热化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z为元素周期表中前四周期元素,且原子序数依次增大.W的基态原子中占据哑铃形原子轨道的电子数为3,![]() 与
与![]() 具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第11列.请回答:
具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第11列.请回答:
(1)Z的基态原子M层的电子排布式为____________________.
(2)W的简单氢化物分子中W原子的__________轨道与氢原子的__________轨道重叠形成![]() 键.(填轨道名称)
键.(填轨道名称)
(3)比较Y的含氧酸的酸性:![]() __________
__________![]() (填“>”或“<”),原因为___________________.
(填“>”或“<”),原因为___________________.
(4)关于Z的化合物![]() (EDTA的结构简式如下图)的说法正确的是_____选项字母).
(EDTA的结构简式如下图)的说法正确的是_____选项字母).
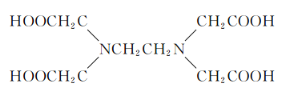
A.![]() 中所含的化学键有离子键、共价键、配位键和氢键
中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为![]() 、
、![]()
C.![]() 的组成元素的第一电离能顺序为
的组成元素的第一电离能顺序为![]()
D.![]() 与
与![]() 互为等电子体,空间构型均为正四面体形
互为等电子体,空间构型均为正四面体形
(5)某离子型氢化物![]() 的晶胞结构如图所示:
的晶胞结构如图所示:
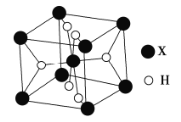
①![]() 的配位数为__________________.
的配位数为__________________.
②![]() 是一种储氢材料,遇水会缓慢反应,该反应的化学方程式为____________.
是一种储氢材料,遇水会缓慢反应,该反应的化学方程式为____________.
③若该晶胞的密度为![]() ,则晶胞的体积为______________
,则晶胞的体积为______________![]() .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究化学反应有着非常重要的意义。
(一)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
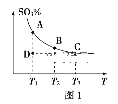
①2SO2(g)+O2(g)![]() 2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
②若反应进行到状态D时,v(正)___v(逆)(填“>”“<”或“=”)。
(二)工业上合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。

从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
A.a B.b C.c D.d
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中充入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
据此判断下列结论正确的是( )
A.在t3时刻反应已经停止
B.t1~t4时刻,A的转化率比B的转化率低
C.在容器中发生的反应为2A+B![]() 2C
2C
D.增大压强,达平衡时混合气体的平均相对分子质量增大
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是
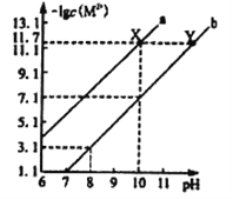
A. 曲线a表示Fe(OH)2饱和溶液中的变化关系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入适CuO
C. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)=C(金刚石,s) ΔH= +1.9kJ/mol,可知石墨比金刚石稳定
D.已知H2(g)+Cl2(g)=2HCl(g) ΔH1= -184.6kJ/mol,则反应HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g)的ΔH= -92.3kJ/mol
Cl2(g)的ΔH= -92.3kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH、![]() 、Cl七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如图所示转化关系(产物H2O未标出),下列说法不正确的是
、Cl七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如图所示转化关系(产物H2O未标出),下列说法不正确的是

A.白色沉淀A可能能溶解在溶液D中
B.在甲中滴加丁可能发生反应:![]() +Ba2++OHBaCO3↓+H2O
+Ba2++OHBaCO3↓+H2O
C.溶液丙与I、![]() 、
、![]() 可以大量共存
可以大量共存
D.溶液甲中一定满足:c(H2CO3)+c(H+)=c(OH)+c(![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com