
����Ŀ�����ʼ��仯�����ڹ�ũҵ���������Ź㷺��Ӧ�á�
��1���¶�Ϊ![]() ʱ����2.0L�����ܱ������г���1.0 mol
ʱ����2.0L�����ܱ������г���1.0 mol ![]() ��������Ӧ
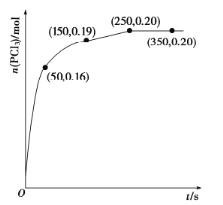
��������Ӧ![]() ������һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ�����������ͼ����Ӧ��ǰ50s��ƽ������
������һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ�����������ͼ����Ӧ��ǰ50s��ƽ������![]() __________����Ӧ�ﵽƽ��������¶ȣ���
__________����Ӧ�ﵽƽ��������¶ȣ���![]() ______���������С�����䡱�����ٴδﵽƽ���
______���������С�����䡱�����ٴδﵽƽ���![]() ��ƽ��Ũ��Ϊ
��ƽ��Ũ��Ϊ![]() ����Ӧ��
����Ӧ��![]() _____���������=��������0��
_____���������=��������0��
��2���¶�Ϊ![]() ʱ����ƽ��ʱ��ϵ����ѹǿΪp���÷�Ӧ��ƽ�ⳣ��
ʱ����ƽ��ʱ��ϵ����ѹǿΪp���÷�Ӧ��ƽ�ⳣ��![]() ______________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
______________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
��3���¶�Ϊ![]() ʱ��������Ӧ���ں�ѹ�����н��У���ﵽƽ���
ʱ��������Ӧ���ں�ѹ�����н��У���ﵽƽ���![]() �����ʵ���__________������ڡ���С�ڡ����ڡ���0.20mol��������___________��
�����ʵ���__________������ڡ���С�ڡ����ڡ���0.20mol��������___________��
��4����֪![]() ˮ�������������
ˮ�������������![]() �������£�
�������£�![]() ��Һ��
��Һ��![]() ����������������NaOH��Һ��Ӧ����
����������������NaOH��Һ��Ӧ����![]() ����
����![]() ��
��![]() ��Һ�и�����Ũ���ɴ�С��˳��Ϊ_________________��
��Һ�и�����Ũ���ɴ�С��˳��Ϊ_________________��
��5�����������ǿ��ԭ�ԣ��ɱ�����Ϊ![]() ��
��![]() ��NaOH��Һ��Ӧ����Ӧ������к������ӵķֲ�������ƽ��ʱij���ӵ�Ũ��ռ����Ũ��֮�͵ķ�������pH�Ĺ�ϵ��ͼ��ʾ��
��NaOH��Һ��Ӧ����Ӧ������к������ӵķֲ�������ƽ��ʱij���ӵ�Ũ��ռ����Ũ��֮�͵ķ�������pH�Ĺ�ϵ��ͼ��ʾ��

��Ϊ��þ����ܴ���![]() ��pHӦ������_________��
��pHӦ������_________��
����֪��25��ʱ��![]() �ĵ��볣��Ϊ
�ĵ��볣��Ϊ![]() ��
��![]() ��
��![]() ����
����![]() ʱ����Һ��
ʱ����Һ��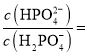 _________��
_________��
���𰸡�![]() ���� ��
���� �� ![]() ����0.042p�� ���� ����ӦΪ�������������ķ�Ӧ���ں�ѹ�����±��ں���������ѹǿС�������ڷ�Ӧ������У�ƽ��ʱ
����0.042p�� ���� ����ӦΪ�������������ķ�Ӧ���ں�ѹ�����±��ں���������ѹǿС�������ڷ�Ӧ������У�ƽ��ʱ![]() �����ʵ�������
�����ʵ������� ![]() 4��5.5�����ڴ������ڵ�����ֵ��������ɣ� 6.2
4��5.5�����ڴ������ڵ�����ֵ��������ɣ� 6.2
��������
(1)����ͼ��֪����Ӧ��ǰ50 s����PCl3�����ʵ���Ϊ0.16 mol�����ݷ�ӦPCl5(g) ![]() PCl3(g)��Cl2(g)֪PCl5�����ʵ����仯Ϊ0.16 mol����Ӧ��ǰ50 s��ƽ������v(PCl5)��0.16 mol��(2 L��50 s)��0.001 6 mol��L��1��s��1����������������ʱ�������¶ȣ���ѧ��Ӧ���ʼӿ죬�ʷ�Ӧ�ﵽƽ��������¶ȣ���v��(Cl2)������ͼ��֪����Ӧ��ƽ���n(PCl3)��0.2 mol�����������Ϊ2 L��c(PCl3)��0.1 mol��L��1�������¶ȣ���Ӧ�ٴδﵽƽ���PCl3��ƽ��Ũ��Ϊ0.18 mol��L��1��˵�������¶ȣ�ƽ�������ƶ�����������������ʱ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�����Ӧ����H��0��
PCl3(g)��Cl2(g)֪PCl5�����ʵ����仯Ϊ0.16 mol����Ӧ��ǰ50 s��ƽ������v(PCl5)��0.16 mol��(2 L��50 s)��0.001 6 mol��L��1��s��1����������������ʱ�������¶ȣ���ѧ��Ӧ���ʼӿ죬�ʷ�Ӧ�ﵽƽ��������¶ȣ���v��(Cl2)������ͼ��֪����Ӧ��ƽ���n(PCl3)��0.2 mol�����������Ϊ2 L��c(PCl3)��0.1 mol��L��1�������¶ȣ���Ӧ�ٴδﵽƽ���PCl3��ƽ��Ũ��Ϊ0.18 mol��L��1��˵�������¶ȣ�ƽ�������ƶ�����������������ʱ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�����Ӧ����H��0��
(2)����ͼ���Ϸ�ӦPCl5(g)![]() PCl3(g)��Cl2(g)֪�¶�ΪT��ʱ����Ӧ�ﵽƽ���n(Cl2)��n(PCl3)��0.2 mol��n(PCl5)��0.8 mol������������������ʵ���Ϊ1.2 mol�����������Ȼ��ס����Ȼ������ʵ��������ֱ�Ϊ1/6��1/6��2/3����ƽ��ʱ��ϵ����ѹǿΪp�����������Ϣ֪���������Ȼ��ס����Ȼ���ƽ���ѹ�ֱ�Ϊp/6��p/6��2p/3���÷�Ӧ��ƽ�ⳣ��Kp��
PCl3(g)��Cl2(g)֪�¶�ΪT��ʱ����Ӧ�ﵽƽ���n(Cl2)��n(PCl3)��0.2 mol��n(PCl5)��0.8 mol������������������ʵ���Ϊ1.2 mol�����������Ȼ��ס����Ȼ������ʵ��������ֱ�Ϊ1/6��1/6��2/3����ƽ��ʱ��ϵ����ѹǿΪp�����������Ϣ֪���������Ȼ��ס����Ȼ���ƽ���ѹ�ֱ�Ϊp/6��p/6��2p/3���÷�Ӧ��ƽ�ⳣ��Kp��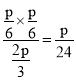 ��(��0.042p)��
��(��0.042p)��
(3)��ӦPCl5(g)![]() PCl3(g)��Cl2(g)������Ϊ�������ʵ�������ķ�Ӧ���¶�ΪT��ʱ������Ӧ�ں�ѹ�����н��У����ŷ�Ӧ�Ľ��У���������������ʵ���������Ҫ��ά��������ѹǿ���䣬�������ݻ�Ӧ������������൱�ڼ�Сѹǿ�����൱��ԭƽ���������������ķ����ƶ����ﵽƽ���PCl3�����ʵ�������0.20 mol��
PCl3(g)��Cl2(g)������Ϊ�������ʵ�������ķ�Ӧ���¶�ΪT��ʱ������Ӧ�ں�ѹ�����н��У����ŷ�Ӧ�Ľ��У���������������ʵ���������Ҫ��ά��������ѹǿ���䣬�������ݻ�Ӧ������������൱�ڼ�Сѹǿ�����൱��ԭƽ���������������ķ����ƶ����ﵽƽ���PCl3�����ʵ�������0.20 mol��
(4)���������Ϣ֪������(H3PO3)Ϊ��Ԫ���ᣬNa2HPO3Ϊ�������γɵ����Σ�Ǩ��Na2CO3��Һ��������0.10 mol��L��1��Na2HPO3��Һ�ʼ��ԣ�һ��ˮ��Զ���ڶ���ˮ���������ˮ�������ģ�����Һ�и�����Ũ���ɴ�С��˳����![]() ��
��
(5)�ٷ���ͼ��֪����þ����ܴ���NaH2PO4��pHӦ������4��5.5(���ڴ������ڵ�����ֵ���������)��
�ڷ���ͼ��֪����pH��8ʱ����Һ�еĺ�����ΪH2PO4����HPO42����c(H��)��1��10��8 mol��L��1����Ka2��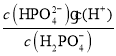 ��6.2��10��8 mol��L��1����
��6.2��10��8 mol��L��1����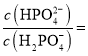 6.2��
6.2��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����˵������ȷ���ǣ� ��
A.0.1mol/L��FeCl3��Һ��0.01mol/L��FeCl3��Һ�У�Fe3+��Ũ��֮�ȴ���10
B.��a mol��L��1�İ�ˮ��0.01mol��L��1������������Ϻ�c(NH4+)��c(Cl��)����NH3��H2O�ĵ��볣��Ϊ![]()
C.pH�Ӻ�Ϊ12��ǿ���������ϣ�pH����Ϊ6
D.0.1mol��L��1 NH4HS��Һ���У�c(NH4+)=c(HS��)��c(S2��)��c(H2S)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���3.36 L CO2����ͨ��200 mL 1.00 mol��L��1NaOH��Һ�У���ַ�Ӧ����Һ��c(CO32-)��c(HCO3-)�ı�ֵΪ(������CO32-��HCO3-��ˮ��) (����)
A.1��1
B.1��2
C.2��1
D.1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4mol A�����2mol B������2L�ܱ������л�ϣ���һ�������·������·�Ӧ��2A(g)��B(g)![]() 2C(g)����2s����C��Ũ��Ϊ0.6mol��L-1������˵����ȷ���ǣ� ��
2C(g)����2s����C��Ũ��Ϊ0.6mol��L-1������˵����ȷ���ǣ� ��
A.������A��ʾ�ķ�Ӧ����Ϊ0.3mol��L-1��s-1
B.������B��ʾ�ķ�Ӧ����Ϊ0.6mol��L-1��s-1
C.2sʱ����A��Ũ��Ϊ0.7mol��L-1
D.2sʱ����B��Ũ��Ϊ0.9mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Fe(OH)2��Cu(OH)2�ı�����Һ�У����������ӵ����ʵ���Ũ�ȵĸ�����[-lgc(M2+)]����ҺpH�ı仯��ϵ��ͼ��ʾ����֪���¶���Ksp[Cu(OH)2]<Ksp[Fe(OH)2]������˵����ȷ����
A. ����a��ʾFe(OH)2������Һ�еı仯��ϵ
B. ��ȥCuSO4��Һ�к��е�����Fe2+���ɼ�����CuO
C. ��Fe(OH)2��Cu(OH)2��������ʱ����Һ��c(Fe2+)��c(Cu2+)=104.6 ��1
D. ��X���Ӧ�ı�����Һ�м�������NaOH���壬��ת��ΪY���Ӧ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿�ۣ���Ҫ����MnO2��������������Fe2O3��Al2O3�����ʣ�Ϊԭ���Ʊ��ߴ�MnO2����������ͼ��ʾ��
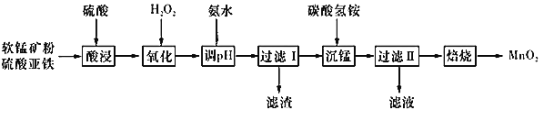
��֪���ٳ����£�Ksp[Fe(OH)3]=8.0��10-38��Ksp [Al(OH)3]=4.0��10-34��
�ڳ����£��������������������Al3+��Fe3+��ȫ������pH�ֱ�Ϊ4.6��3.4��Mn2+��ʼ������pHΪ8.1��
�۳����£�����Һ�н����������ʵ���Ũ��С�ڻ����1��10-5mol��L-lʱ������Ϊ�ý��������ѱ�������ȫ��
��1��ʵ����Ԥ����Ҫʹ��480 mL 2 mol��L��1�����ᣬ����18.4 mol��L-1��Ũ���������ƣ�������Ͳ��ȡŨ����________mL������ʱ���ò�����������Ͳ���ձ��Ͳ������⣬����_______��
��2����������������ԭ��Ϊ_____________________________��
��3��������������в�����Ũ����������ᣬԭ����_____________(�����ӷ���ʽ��ʾ�����������ʱΪ�ӿ췴Ӧ���ʿɲ�ȡ�Ĵ�ʩ��_____________________������д����)��
��4�����백ˮӦ����pH�ķ�ΧΪ_______��������II����������ΪMnCO3����Һ�����ʵ���Ҫ�ɷ���_______���ѧʽ��
��5������̼����鱗��������Ĺ��̳�Ϊ�����̡���
�١����̡������зų�CO2����Ӧ�����ӷ���ʽΪ_________��
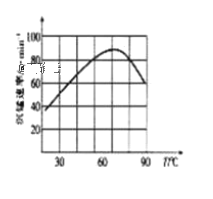
�ڡ����̡������г����������¶ȵĹ�ϵ��ͼ��ʾ�����¶ȸ���60��ʱ���������������¶����߶�������ԭ�������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͼ���Ӧ���ϵ���(����)

A. ���ڴﵽƽ��״̬��N2(g)��3H2(g)![]() 2NH3(g)��t0ʱ�̳�����һ����NH3��ƽ�������ƶ�
2NH3(g)��t0ʱ�̳�����һ����NH3��ƽ�������ƶ�
B. P2>P1��T1>T2
C. ��ͼ���ʾ�ķ���ʽΪ��2A===B��3C
D. ���ڷ�Ӧ2X(g)��3Y(g)![]() 2Z(g)����H<0��y���Ա�ʾY�İٷֺ���
2Z(g)����H<0��y���Ա�ʾY�İٷֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Pt�缫���1 LŨ�Ⱦ�Ϊ0.1 mol��L-1��HCl��CuSO4�Ļ����Һ,װ����ͼ,����˵����ȷ����(����)

A.��ʼʱ������H2�ų�
B.��ʼʱ�����Ϸ���:Cu2++2e-Cu
C.������������,SO42-������缫��Ӧ
D.����·��ͨ�����ӵ�������0.1 molʱ,��ʱ�����ŵ�����ӷ����˱仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ϻϳ�CH3OH��ԭ��Ϊ��2H2(g)+CO![]() CH3OH(g)��һ���¶��£���1L�����ܱ������г���H2��CO����Ӧ��ƽ��ʱCH3OH����������뷴Ӧ��Ͷ��֮��(n(H2)/n(CO))�Ĺ�ϵ��ͼ��ʾ������˵���������
CH3OH(g)��һ���¶��£���1L�����ܱ������г���H2��CO����Ӧ��ƽ��ʱCH3OH����������뷴Ӧ��Ͷ��֮��(n(H2)/n(CO))�Ĺ�ϵ��ͼ��ʾ������˵���������
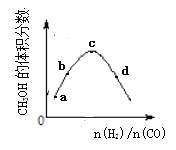
A. ��ͬ�����£��ﵽƽ��ʱ���������ܶ��뷴Ӧǰ��ͬ
B. a��b��c��d�ĵ���,c��CO��ת�������
C. ��Ͷ��ʱn(CO)���䣬a��b��c��d�ĵ���d��CH3OH�����ʵ������
D. ͼ���� c�㵽d�㣬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com