
【题目】将4mol A气体和2mol B气体在2L密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( )
2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( )
A.用物质A表示的反应速率为0.3mol·L-1·s-1
B.用物质B表示的反应速率为0.6mol·L-1·s-1
C.2s时物质A的浓度为0.7mol·L-1
D.2s时物质B的浓度为0.9mol·L-1
科目:高中化学 来源: 题型:
【题目】COCl2 的分解反应为: COCl2(g)=Cl2(g)+CO(g) △H=+108 kJmol-1。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是

A.第 4min 时,改变的反应条件是升高温度
B.第 6min 时,V 正(COCl2)>V 逆(COCl2)
C.第 8min 时的平衡常数 K=2.34
D.第 10min 到 14min 未标出 COCl2 的浓度变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
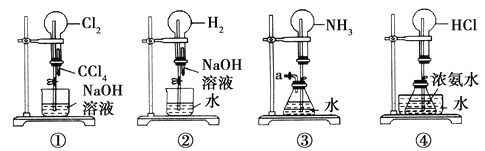
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.25 ℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)=c(OH-)=c(![]() )=c(Cl-)
)=c(Cl-)
B.25 ℃时,向10 mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液: c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(![]() )的大小顺序为③>②>①
)的大小顺序为③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验。


已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是________________________________。
(3)实验④反应的离子方程式是__________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________(用必要的文字和化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)=C(金刚石,s) ΔH= +1.9kJ/mol,可知石墨比金刚石稳定
D.已知H2(g)+Cl2(g)=2HCl(g) ΔH1= -184.6kJ/mol,则反应HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g)的ΔH= -92.3kJ/mol
Cl2(g)的ΔH= -92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物在工农业生产中有着广泛的应用。
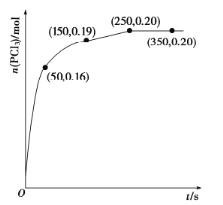
(1)温度为![]() 时,向2.0L恒容密闭容器中充入1.0 mol
时,向2.0L恒容密闭容器中充入1.0 mol ![]() ,发生反应
,发生反应![]() ,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率
,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率![]() __________,反应达到平衡后,升高温度,则
__________,反应达到平衡后,升高温度,则![]() ______(填“增大”“减小”或“不变”),再次达到平衡后,
______(填“增大”“减小”或“不变”),再次达到平衡后,![]() 的平衡浓度为
的平衡浓度为![]() ,则反应的
,则反应的![]() _____(填“>”“=”或“<”)0。
_____(填“>”“=”或“<”)0。
(2)温度为![]() 时,若平衡时体系的总压强为p,该反应的平衡常数
时,若平衡时体系的总压强为p,该反应的平衡常数![]() ______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)温度为![]() 时,上述反应若在恒压容器中进行,则达到平衡后,
时,上述反应若在恒压容器中进行,则达到平衡后,![]() 的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
(4)已知![]() 水解可生成亚磷酸
水解可生成亚磷酸![]() 。常温下,
。常温下,![]() 溶液的
溶液的![]() ,亚磷酸与足量的NaOH溶液反应生成
,亚磷酸与足量的NaOH溶液反应生成![]() ,则
,则![]() 的
的![]() 溶液中各离子浓度由大到小的顺序为_________________。
溶液中各离子浓度由大到小的顺序为_________________。
(5)亚磷酸具有强还原性,可被氧化为![]() 。
。![]() 与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。
与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。

①为获得尽可能纯的![]() ,pH应控制在_________。
,pH应控制在_________。
②已知:25℃时,![]() 的电离常数为
的电离常数为![]() ,
,![]() ,
,![]() ,则
,则![]() 时,溶液中
时,溶液中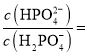 _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种飞船以![]() 和
和![]() 为动力源,发生反应:
为动力源,发生反应:![]() ,反应温度可高达2700℃,若有
,反应温度可高达2700℃,若有![]() 被氧化,则下列判断不正确的是( )
被氧化,则下列判断不正确的是( )
A.生成![]() (标准状况下)
(标准状况下)
B.被还原的氮原子的物质的量为![]()
C.转移电子的物质的量为![]()
D.氧化产物比还原产物多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的三种方法。回答下列问题:
Ⅰ.直接法

(1)“转化”步骤发生反应的离子反应方程式___(已知:Ca3(PO4)2难溶于水)。
(2)“操作Ⅰ”是___。
Ⅱ.酸碱中和法
(3)氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾。
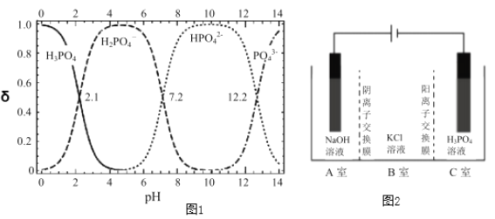
①由图1判断制备磷酸二氢钾(达80%)的最佳pH范围___。
②K2HPO4溶液呈___性(填“酸”、“碱”、“中”)。
Ⅲ.电解法
电解法制取KH2PO4的原理如图2所示。一定件下,还可得到NaClO3。
(4)在___室(填标号)可得到KH2PO4;写出产生ClO3-的电极反应式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com