
【题目】COCl2 的分解反应为: COCl2(g)=Cl2(g)+CO(g) △H=+108 kJmol-1。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是

A.第 4min 时,改变的反应条件是升高温度
B.第 6min 时,V 正(COCl2)>V 逆(COCl2)
C.第 8min 时的平衡常数 K=2.34
D.第 10min 到 14min 未标出 COCl2 的浓度变化曲线
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.含![]() 个离子的固体
个离子的固体![]() 溶于水配成1L溶液,所得溶液中
溶于水配成1L溶液,所得溶液中![]() 的物质的量浓度为2
的物质的量浓度为2![]()
B.![]() 在空气中长期放置变浑浊的离子方程式为:
在空气中长期放置变浑浊的离子方程式为:![]()
C.可以用澄清石灰水鉴别![]() 和
和![]()
D.滴加KSCN显红色的溶液中存在:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了研究氯气的性质,做以下探究实验。向KI溶液通入氯气溶液变为黄色;继续通入氯气一段时间后,溶液黄色退去,变为无色;继续通入氯气,最后溶液变为浅黄绿色,查阅资料:I2+I-I3-,I2、I3-在水中均呈黄色。

(1)为确定黄色溶液的成分,进行了以下实验:取 2~3 mL 黄色溶液,加入足量 CCl4,振荡静置,CCl4层呈紫红色,说明溶液中存在______,生成该物质的化学方程式为______,水层显浅黄色,说明水层显黄色的原因是______;
(2)继续通入氯气,溶液黄色退去的可能的原因______;
(3)NaOH 溶液的作用______,反应结束后,发现烧杯中溶液呈浅黄绿色,经测定该溶液的碱性较强,一段时间后溶液颜色逐渐退去,其中可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入2 mol SO2、1 mol O2,向乙中充入4mol SO2、2 mol O2。甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,.关闭活塞K,使两容器中各自发生下述反应:2 SO2(g)+O2(g)![]() 2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是

A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间.再次达到平衡.甲的体积为1.4 L
D.平衡后向甲中再充入2mol SO2、1mol O2和3moLSO3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z的氢化物稳定性Y>Z
B.Y单质的熔点高于X单质
C.X、W、Z能形成具有强氧化性的XZW
D. 中W和Y都满足8电子稳定结构
中W和Y都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古埃及人在公元前一千多年前曾用橄榄石(硅酸盐)作饰品,称它为“太阳的宝石”。某小组以某橄榄石(主要成分可看作为MgO、FeO和SiO2,还含有少量的MnO等)为原料制备工业合成氨的活性催化剂(FeO和Fe2O3质量比为9:20的混合物)的一种流程如下:
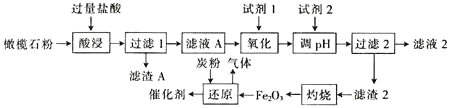
金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Mg2+ | 7.6 | 9.4 |
Fe2+ | 6.5 | 9.9 |
Fe3+ | 1.5 | 3.3 |
Mn2+ | 8.2 | 10.6 |
回答以下问题:
(1)从绿色化学角度分析,试剂1宜选择___(填字母)。加入试剂1的目的是___(用离子方程式表示)。
a.H2O2 b.MnO2 c.HNO3 d.K2Cr2O7
(2)调节pH范围为___。
(3)单位时间内“酸浸”中金属浸出率与温度、盐酸浓度的关系如图所示。
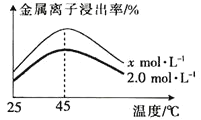
x___(填“>”“<”或“=”)2。当盐酸浓度相同时,温度高于45℃,浸出率降低的主要原因是___。
(4)“还原”过程中,不仅要控制温度,而且要控制氧化铁和炭粉(C)的比例。若“还原”时产生气体的相对分子质量为36,理论上,480kgFe2O3需要加入___kg炭粉(C)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A.0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B.将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为![]()
C.pH加和为12的强酸与弱酸混合,pH可能为6
D.0.1mol·L-1 NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.6gFe、Fe2O3和CuO的混合粉末加入到100mL一定物质的量浓度的盐酸中,充分反应,生成标准状况下的氢气896mL,过滤,滤渣经洗涤、干燥后得到1.28g固体纯净物,经检验滤液中只含有一种溶质。请回答:
(1)固体混合物中CuO的质量___。
(2)盐酸的浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( )
2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( )
A.用物质A表示的反应速率为0.3mol·L-1·s-1
B.用物质B表示的反应速率为0.6mol·L-1·s-1
C.2s时物质A的浓度为0.7mol·L-1
D.2s时物质B的浓度为0.9mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com