
【题目】下列叙述与图象对应符合的是( )

A. 对于达到平衡状态的N2(g)+3H2(g)![]() 2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
B. P2>P1,T1>T2
C. 该图象表示的方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g)![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O)D.4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验。


已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是________________________________。
(3)实验④反应的离子方程式是__________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________(用必要的文字和化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物在工农业生产中有着广泛的应用。
(1)温度为![]() 时,向2.0L恒容密闭容器中充入1.0 mol
时,向2.0L恒容密闭容器中充入1.0 mol ![]() ,发生反应
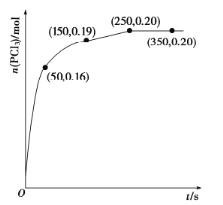
,发生反应![]() ,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率
,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率![]() __________,反应达到平衡后,升高温度,则
__________,反应达到平衡后,升高温度,则![]() ______(填“增大”“减小”或“不变”),再次达到平衡后,
______(填“增大”“减小”或“不变”),再次达到平衡后,![]() 的平衡浓度为
的平衡浓度为![]() ,则反应的
,则反应的![]() _____(填“>”“=”或“<”)0。
_____(填“>”“=”或“<”)0。
(2)温度为![]() 时,若平衡时体系的总压强为p,该反应的平衡常数
时,若平衡时体系的总压强为p,该反应的平衡常数![]() ______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)温度为![]() 时,上述反应若在恒压容器中进行,则达到平衡后,
时,上述反应若在恒压容器中进行,则达到平衡后,![]() 的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
(4)已知![]() 水解可生成亚磷酸
水解可生成亚磷酸![]() 。常温下,
。常温下,![]() 溶液的
溶液的![]() ,亚磷酸与足量的NaOH溶液反应生成
,亚磷酸与足量的NaOH溶液反应生成![]() ,则
,则![]() 的
的![]() 溶液中各离子浓度由大到小的顺序为_________________。
溶液中各离子浓度由大到小的顺序为_________________。
(5)亚磷酸具有强还原性,可被氧化为![]() 。
。![]() 与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。
与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。

①为获得尽可能纯的![]() ,pH应控制在_________。
,pH应控制在_________。
②已知:25℃时,![]() 的电离常数为
的电离常数为![]() ,
,![]() ,
,![]() ,则
,则![]() 时,溶液中
时,溶液中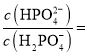 _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- )
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡OH-正向移动,n(OH-)降低
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别加入0.3 g锌粉,醋酸生成的氢气比盐酸多
D.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中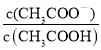 值增大
值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种飞船以![]() 和
和![]() 为动力源,发生反应:
为动力源,发生反应:![]() ,反应温度可高达2700℃,若有
,反应温度可高达2700℃,若有![]() 被氧化,则下列判断不正确的是( )
被氧化,则下列判断不正确的是( )
A.生成![]() (标准状况下)
(标准状况下)
B.被还原的氮原子的物质的量为![]()
C.转移电子的物质的量为![]()
D.氧化产物比还原产物多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
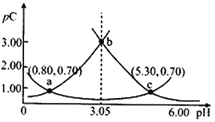
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CuCl2酸性溶液中的FeCl3,加热搅拌的条件下加入一种试剂,然后再加入适量盐酸,该试剂不能是( )
A.Cu(OH)2B.CuCO3C.NaOHD.CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。

(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com