
【题目】标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1NaOH溶液中,充分反应后溶液中c(CO32-)与c(HCO3-)的比值为(不考虑CO32-、HCO3-的水解) ( )
A.1∶1
B.1∶2
C.2∶1
D.1∶3
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际公认的安全、无毒的绿色消毒剂,沸点11℃,凝固点-59℃。工业上,可用下列原理制备ClO2(液相反应):![]() 。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
A.在标准状况下,2240mL ClO2含有原子数为0.3NA
B.若生成1.5mol Na2SO4,则反应后的溶液中Fe3+数目为0.2NA
C.48.0g FeS2完全反应,则上述反应中转移电子数为6NA
D.每消耗30mol NaClO3,生成的水中氢氧键数目为14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O)D.4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
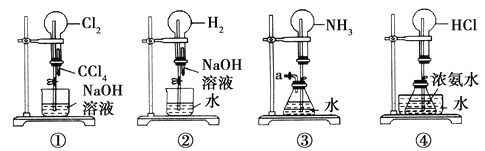
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g)![]() 3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是 ( )
3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是 ( )
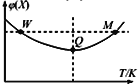
A. Q点时,Y的转化率最大
B. 升高温度,平衡常数增大
C. W点X的正反应速率等于M点X的正反应速率
D. 平衡时充入Z,达到新平衡时Z的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.25 ℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)=c(OH-)=c(![]() )=c(Cl-)
)=c(Cl-)
B.25 ℃时,向10 mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液: c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(![]() )的大小顺序为③>②>①
)的大小顺序为③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组取一定质量的FeSO4固体,利用下图装置进行实验。


已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是________________________________。
(3)实验④反应的离子方程式是__________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________(用必要的文字和化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
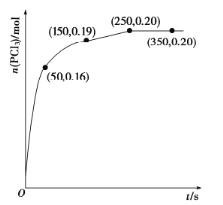
【题目】磷单质及其化合物在工农业生产中有着广泛的应用。
(1)温度为![]() 时,向2.0L恒容密闭容器中充入1.0 mol
时,向2.0L恒容密闭容器中充入1.0 mol ![]() ,发生反应
,发生反应![]() ,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率
,经过一段时间后达到平衡,反应过程中测定的部分数据如下图。反应在前50s的平均速率![]() __________,反应达到平衡后,升高温度,则
__________,反应达到平衡后,升高温度,则![]() ______(填“增大”“减小”或“不变”),再次达到平衡后,
______(填“增大”“减小”或“不变”),再次达到平衡后,![]() 的平衡浓度为
的平衡浓度为![]() ,则反应的
,则反应的![]() _____(填“>”“=”或“<”)0。
_____(填“>”“=”或“<”)0。
(2)温度为![]() 时,若平衡时体系的总压强为p,该反应的平衡常数
时,若平衡时体系的总压强为p,该反应的平衡常数![]() ______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)温度为![]() 时,上述反应若在恒压容器中进行,则达到平衡后,
时,上述反应若在恒压容器中进行,则达到平衡后,![]() 的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
的物质的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
(4)已知![]() 水解可生成亚磷酸
水解可生成亚磷酸![]() 。常温下,
。常温下,![]() 溶液的
溶液的![]() ,亚磷酸与足量的NaOH溶液反应生成
,亚磷酸与足量的NaOH溶液反应生成![]() ,则
,则![]() 的
的![]() 溶液中各离子浓度由大到小的顺序为_________________。
溶液中各离子浓度由大到小的顺序为_________________。
(5)亚磷酸具有强还原性,可被氧化为![]() 。
。![]() 与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。
与NaOH溶液反应,反应混合物中含磷各粒子的分布分数(平衡时某粒子的浓度占粒子浓度之和的分数)与pH的关系如图所示。

①为获得尽可能纯的![]() ,pH应控制在_________。
,pH应控制在_________。
②已知:25℃时,![]() 的电离常数为
的电离常数为![]() ,
,![]() ,
,![]() ,则
,则![]() 时,溶液中
时,溶液中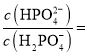 _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CuCl2酸性溶液中的FeCl3,加热搅拌的条件下加入一种试剂,然后再加入适量盐酸,该试剂不能是( )
A.Cu(OH)2B.CuCO3C.NaOHD.CuO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com