
科目: 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A. 1L 0.1 mol·L-1CH3COOH溶液中含H+的数目为0.1NA
B. 标准状况下.2.24LCl2溶于水,转移的电子数为0.1NA
C. 100g质量分数为46%的酒精溶液中含氧原子总数为4NA
D. 常温下,将1molFe加入足量硝酸中,生成H2的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连,请回答以下问题:

(1)若X、Y是惰性石墨电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,在X极附近观察到的现象是______________________________;Y电极上的电极反应式是 ___________________,电解NaCl溶液的离子方程式是________________________________。
(2)若要在铜制品上镀Ag,则电解质溶液a可为___________________,Y电极反应式为_________________________________。
(3)若上图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式_________________,电池工作过程中,正极附近的pH将______(填“增大、减小或不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下化学反应:![]() 现有容积相同且固定不变的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量
现有容积相同且固定不变的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量![]() 如表所列:
如表所列:
容器 |
|
| N2(mol) |
|
甲 | 2 | 1 | 0 |
|
乙 | 1 |
| 0 |
|
丙 | 1 |
| 1 |
|
根据以上数据,下列叙述不正确的是
A.![]()
B.![]()
C.![]()
D.在上述条件下反应生成![]() 气体放热
气体放热![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-![]() 2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。

①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是__;
(2)已知:
ⅰ.![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.

请回答:
①步骤Ⅰ的目的是__;
②若G为气体,且相对分子质量是44,则E的结构简式是__;E的核磁共振氢谱中有__个吸收峰(填数字);
③F→H的反应类型是__;
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式__;
⑤A的结构简式是__;
上述转化中B→D的化学方程式是__;
(3)已知A的某种同分异构体K具有如下性质:
①K与FeCl3反应,溶液呈紫色
②K在一定条件下可发生银镜反应
③K分子中苯环上的取代基上无甲基
请写出K所有可能的结构简式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
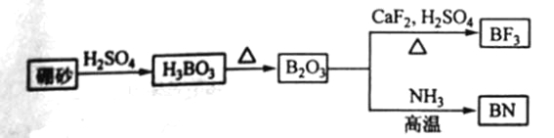
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】水杨酸甲酯是一种无色透明油状液体,相对分子质量为152,密度为1.184gcm﹣3,沸点223.3℃,熔点﹣86℃,微溶于水,易溶于有机溶剂,露置在空气中则易缓慢变色。由水杨酸和甲醇在浓硫酸存在条件下反应制得水杨酸甲酯(冬青油)的反应如下:

某学校的实验探究小组利用如图装置制备冬青油.步骤如下

①将三颈烧瓶、量筒,置于烘箱中干燥10min;
②用天平称取6.9g水杨酸,用量筒分别量取30mL(约24g)甲醇,6mL浓硫酸,然后将3种试剂分别加入已干燥的三颈烧瓶中,组装好实验装置后置于磁力搅拌加热器上加热;
③加热到85~95℃,反应结束后将盛有混合物的烧瓶置于冷水浴中冷却,然后再将冷却后的混合物倒入分液漏斗中,依次加入NaHCO3溶液和30mL水,充分震荡,静置,分层;
④弃去水层,将有机层注入干燥的锥形瓶中,加入适量无水氯化钙;
⑤将步骤④所得的产品蒸馏,收集221~224℃的馏分,称得产物质量为4.56g
试回答下列问题:
(1)装置中仪器a的作用是_______________;水应该从________(填“Ⅰ”或“Ⅱ”)处流入,仪器b的适宜规格为___________(填序号);
①10℃ ②50℃ ③150℃
(2)加入NaHCO3溶液的目的除了将冬青油中的甲醇、水杨酸、硫酸等除去外,还有___________;加入水震荡分层后,冬青油的粗产品在_______(填“上”或“下”)层;
(3)在本实验分离过程中,水层应该从分液漏斗的_________________(填“上口倒出”或“下口放出”);
(4)本次实验冬青油的产率是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下列有关能源的材料,回答有关问题:
(1)在常温,1.01×105Pa时,48g 甲醇在足量的氧气中充分燃烧生成二氧化碳和液态水,放出1089kJ的热量,则表示甲醇燃烧热的热化学方程式为____________________________。
(2)在生产和生活中经常遇到化学能与电能的相互转化。在如图甲、乙两装置中,甲中负极电极反应式为____________________________,甲中的阳离子向 _______ 极移动(填“正”或“负”);乙中铝电极作____极,乙中正极电极反应式为____________________________
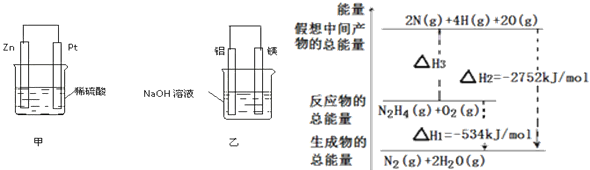
(3)肼(N2H4)可作为火箭发动机的燃料,有关肼化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为944、O=O为500、N-N为154,则反应物转化为中间产物的ΔH3=_________,断裂1 mol N—H键所需的能量是__________ kJ。
(4)工业制氢气的一个重要反应是:CO(g)+ H2O(g) =CO2(g) + H2(g),
已知25℃时: C(石墨)+O2(g) = CO2(g) ; △H1 = -394 kJmol-1
C(石墨)+![]() O2(g) = CO(g); △H2 = -111 kJmol-1
O2(g) = CO(g); △H2 = -111 kJmol-1
H2(g)+ ![]() O2 (g)=H2O(g); △H3= -242kJmol-1
O2 (g)=H2O(g); △H3= -242kJmol-1
试计算25℃时CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H=____________kJmol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com