
科目: 来源: 题型:
【题目】下列说法正确的是
A.![]()
![]() ,结论:
,结论:![]() 的燃烧热为
的燃烧热为![]()
B.稀溶液中有![]()
![]() ,结论:将盐酸与氨水的稀溶液混合后,若生成
,结论:将盐酸与氨水的稀溶液混合后,若生成![]() ,则会放出
,则会放出![]() 的能量
的能量
C.相同条件下,如果![]() 氢原子所具有的能量为
氢原子所具有的能量为![]() ,
,![]() 氢分子所具有的能量为
氢分子所具有的能量为![]() ,则
,则![]()
D.![]() 气态乙硼烷
气态乙硼烷![]() 在
在![]() 中完全燃烧生成固态
中完全燃烧生成固态![]() 和液态水,同时放出
和液态水,同时放出![]() 的热量,该反应的热化学方程式为
的热量,该反应的热化学方程式为![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V2++2H+![]() VO2++V3++H2O以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )
VO2++V3++H2O以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )

A.全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O
B.图中a电极为阴极,N物质是H2
C.全钒液流电池充电时,V3+被氧化为VO2+
D.电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关反应热的叙述正确的是
A.已知![]()
![]()
![]() ,则氢气的燃烧热为
,则氢气的燃烧热为![]()
B.![]() ,石墨
,石墨![]() ,金刚石
,金刚石![]() ,说明石墨比金刚石稳定
,说明石墨比金刚石稳定
C.![]() ,
,![]() 恒温恒容条件下达到平衡后加入X,上述反应的
恒温恒容条件下达到平衡后加入X,上述反应的![]() 增大
增大
D.已知![]() ;
;![]() 则
则![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程都与热量变化有关,其中叙述正确的是
A.Ba(OH)2·8H2O与NH4Cl常温下混合就能反应,故该反应放热
B.已知2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol–1,故H2的燃烧热为241.8kJ·mol–1
C.已知H+-(aq)+OH-(aq)==H2O-(l)ΔH=-57.31kJ·mol–1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s)ΔH<-57.31kJ·mol–1
D.由图可知,反应C(金刚石,s)=C(石墨,s)的焓变ΔH=ΔH1-ΔH2
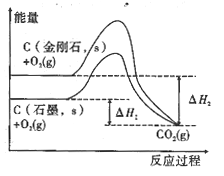
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.反应2CO(g)+O2(g)=2CO2(g)在一定条件下能自发进行的原因是ΔS>0
B.由Ksp[Mg(OH)2]=1.8×10-11可知常温下pH=8的溶液中,c(Mg2+)≤1.8×10-5mol·L1
C.反应H2(g)+Cl2(g)=2HCl(g)的ΔH可用下式换算:ΔH=反应中断裂的旧化学键键能之和-反应中形成的新化学键键能之和
D.由反应C(s)+1/2O2 (g)=CO(g)ΔH=-111 kJ·mol1可知C的燃烧热是111 kJ·mol1
查看答案和解析>>
科目: 来源: 题型:
【题目】现在科学家正在寻求将太阳能转化成化学能的方法,其中之一就是利用太阳能将![]() 分解成
分解成![]() ,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
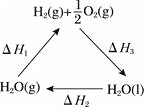
A.图中![]()
B.如果![]() 的键能为
的键能为![]() ,
,![]() 键能为
键能为![]() ,则断开
,则断开![]() 水蒸气中
水蒸气中![]() 键所需要的太阳能为
键所需要的太阳能为![]()
C.![]() 燃烧热为
燃烧热为![]()
D.水蒸气所具有的能量比液态水多![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2的燃烧热为ΔH=-285.8 kJ·mol-1,CO的燃烧热为ΔH=-282.8 kJ·mol-1;现有H2和CO组成的混合气体5.6 L(标准状况),经充分燃烧后,放出总热量为71.15 kJ,并生成液态水。下列说法正确的是
A. CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-282.8 kJ·mol-1
B. H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1
C. 燃烧前混合气体中CO的体积分数为60%
D. 燃烧后的产物全部与足量的过氧化钠作用可产生0.125 mol O2
查看答案和解析>>
科目: 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。图中表示两个常见的固氮反应:
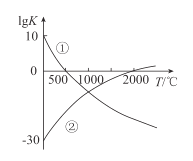
①![]()
②![]() 的平衡常数
的平衡常数![]() 与温度的关系,根据图中的数据判断下列说法正确的是( )
与温度的关系,根据图中的数据判断下列说法正确的是( )
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置 (夹持装置已略)如图所示:下列说法错误的是( )
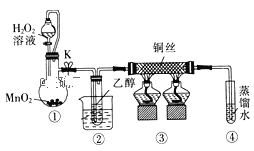
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出,再停止加热
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com