
科目: 来源: 题型:
【题目】阳离子交换膜电解槽运用到氯碱工业,使产品的纯度大大提高,主要归功于阳离子交换膜的严格把关,它只允许阳离子自由通过,其工作原理如图所示。

(1)在氯碱工业中电解饱和食盐水制备氢气、氯气和氢氧化钠溶液时,饱和食盐水的入口应该是______(填“C”或“D”)。
(2)该装置也可用于物质的提纯,工业品氢氧化钾的溶液中含有某些含氧酸根杂质(如SO42-),可以用阳离子交换膜电解槽电解提纯。除去杂质后氢氧化钾溶液从液体出口_________(填“A”或“B”)导出。
(3)阳离子交换膜的诞生极大促进了电解工业的发展,我们不妨大胆设想,假设阴离子交换膜也已经诞生,同时使用阳离子交换膜和阴离子交换膜电解硫酸钠溶液,可以同时制备产品氢气、氧气、氢氧化钠溶液和硫酸溶液四种物质。某同学设计了如图所示的装置,请你指出硫酸钠溶液的入口是_______(填“C”“G”或“D”)。

查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水
在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水![]() 主要以
主要以![]() 形式存在
形式存在![]() 提取
提取![]() 的工艺流程如下:
的工艺流程如下:
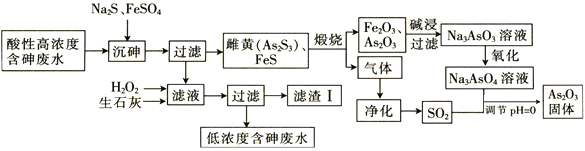
回答下列问题:
![]() 上述流程的__________过程中由于条件的原因,造成生成物中混有
上述流程的__________过程中由于条件的原因,造成生成物中混有![]() ,为证明
,为证明![]() 的存在,可利用
的存在,可利用![]() 具有____________性的这一物理性质。
具有____________性的这一物理性质。
![]() 调节
调节![]() 时,由
时,由![]() 制备
制备![]() 的离子方程式为_____________________________。
的离子方程式为_____________________________。
![]() 常温下,用NaOH溶液滴定
常温下,用NaOH溶液滴定![]() 时,各种微粒的物质的量分数随pH的变化曲线如图所示:
时,各种微粒的物质的量分数随pH的变化曲线如图所示:
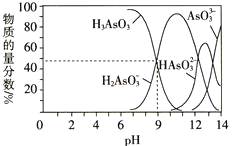
![]() AsO
AsO![]() 为________元________
为________元________![]() 填“强”或“弱”
填“强”或“弱”![]() 酸。
酸。
![]() 由7调节至10的过程中发生反应的离子方程式为____________________________。
由7调节至10的过程中发生反应的离子方程式为____________________________。 ![]() 的一级电离平衡常数
的一级电离平衡常数![]() _______。
_______。
![]() 滤渣Ⅰ中含有
滤渣Ⅰ中含有![]() 、
、![]() 、
、![]() 和_______________
和_______________![]() 填化学式
填化学式![]() ;已知
;已知
![]() ,含砷污染物允许排放标准为不大于
,含砷污染物允许排放标准为不大于![]() 。若低浓度含砷废水
。若低浓度含砷废水![]() 假设砷均以
假设砷均以![]() 形式存在
形式存在![]() 中
中![]() 的浓度为
的浓度为![]() ,则低浓度含砷废水中
,则低浓度含砷废水中![]() 的浓度为_________
的浓度为_________![]() ,________
,________![]() 填“符合”或“不符合”
填“符合”或“不符合”![]() 排放标准。
排放标准。
查看答案和解析>>
科目: 来源: 题型:
【题目】卤族元索的单质和化合物在生产生活中有重要的用途。
(1)基态溴原子的核外电子排布式为[Ar]_________。
(2)在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是_________。
(3)HIO3的酸性_________(填“强于”或“弱于”)HIO4,原因是_________。
(4)ClO2-中心氯原子的杂化类型为_________,ClO3-的空间构型为_________。
(5)晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(![]() ,
, ![]() ,0);C处为(1,1,1)。则D处微粒的坐标参数为_________。
,0);C处为(1,1,1)。则D处微粒的坐标参数为_________。
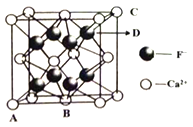
②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3,则晶胞中Ca2+与离它最近的F-之间的距离为_________nm(设NA为阿伏加德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将2molI2(g)和1molH2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示.
2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示.

(1)达平衡时,I2(g)的物质的量浓度为 .
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。
①恒温条件下,扩大反应容器体积
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒容条件下,升高温度
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c 均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理________,哪些违反了洪特规则________。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(2)![]() 可用于制造火柴,其分子结构如图所示。
可用于制造火柴,其分子结构如图所示。

![]() 分子中硫原子的杂化轨道类型为________。
分子中硫原子的杂化轨道类型为________。
![]() 每个
每个![]() 分子中含有的孤电子对的数目为________。
分子中含有的孤电子对的数目为________。
(3)科学家合成了一种阳离子“![]() ”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“
”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“![]() ”的化学式为“
”的化学式为“![]() ”的离子晶体,其电子式为________。分子
”的离子晶体,其电子式为________。分子![]() 中键与键之间的夹角为
中键与键之间的夹角为![]() ,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为________。
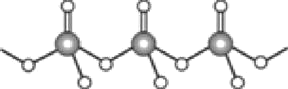
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径
碳酸盐 |
|
|
|
|
热分解温度 | 402 | 900 | 1172 | 1360 |
金属阳离子半径 | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是_____________。
(6)石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为![]() ,
,![]() 键的键长为
键的键长为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则石墨晶体的层间距为________cm。
,则石墨晶体的层间距为________cm。
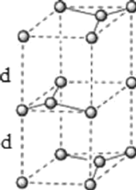 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年10月3日瑞典皇家科学院宣布,将授予美国科学家弗朗西丝![]() 阿诺德、美国科学家乔治
阿诺德、美国科学家乔治![]() 史密斯和英国科学家格雷戈里
史密斯和英国科学家格雷戈里![]() 温特三位科学家2018年诺贝尔化学奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。获奖者已经利用达尔文原理开发出造福人类的新型化学品。第一个药物阿达木单抗于2002年获批,用于治疗类风湿关节炎、银屑病和炎症性肠病,其结构式如图1所示:
温特三位科学家2018年诺贝尔化学奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。获奖者已经利用达尔文原理开发出造福人类的新型化学品。第一个药物阿达木单抗于2002年获批,用于治疗类风湿关节炎、银屑病和炎症性肠病,其结构式如图1所示:

(1)阿达木单抗中碳原子的杂化方式为________,所含元素中前10号元素的电负性由小到大的顺序为________。
(2)弗朗西斯阿诺德主要研究酶的定向进化,金属酶含有一种或几种金属离子,金属酶种类很多,以含锌、铁、铜的酶最多,如铁金属酶一细胞色素,也有含有钼、锰等其他金属离子的酶。
![]() 基态Fe原子中,核外电子占据的轨道数为________,
基态Fe原子中,核外电子占据的轨道数为________,![]() 的价电子轨道表示式为________,检验
的价电子轨道表示式为________,检验![]() 常用KSCN溶液,其阴离子的等电子体为________
常用KSCN溶液,其阴离子的等电子体为________![]() 任写一种分子
任写一种分子![]() 。
。
![]() 与Fe属于同一周期,且核外最外层电子构型相同,但Ca的熔点沸点都比Fe低,原因是________。
与Fe属于同一周期,且核外最外层电子构型相同,但Ca的熔点沸点都比Fe低,原因是________。
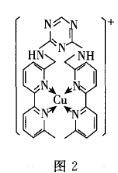
(3)![]() 是人体多种酶的辅助因子,其与某有机物生成的配位离子
是人体多种酶的辅助因子,其与某有机物生成的配位离子![]() 图
图![]() 具有酶的某些特性。该离子中存在的化学键有________。
具有酶的某些特性。该离子中存在的化学键有________。
![]() 离子键
离子键 ![]() 共价键
共价键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 范德华力
范德华力
(4)如图3是晶体![]() 的结构,该晶体是一种磁性材料,能导电。
的结构,该晶体是一种磁性材料,能导电。
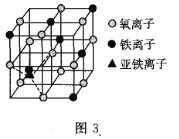
![]() 晶胞中铁离子处于氧离子围成的________
晶胞中铁离子处于氧离子围成的________![]() 填空间结构
填空间结构![]() 空隙。
空隙。
![]() 若晶胞的体对角线长为
若晶胞的体对角线长为![]() ,则
,则![]() 晶体的密度为________
晶体的密度为________![]()
![]() 阿伏加德罗常数用
阿伏加德罗常数用![]() 表示
表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表中第四周期的部分元素![]() 从左到右按原子序数递增排列
从左到右按原子序数递增排列![]() ,根据要求回答下列问题:
,根据要求回答下列问题:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______![]() 填元素名称
填元素名称![]() 。
。
(2)以上元素中,属于s区的元素有_________种,属于d区的元素有______种。
(3)第一电离能![]() ________
________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() 。
。
(4)现有含钛的两种颜色的晶体,![]() 的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为
的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为![]() 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:
![]() 分别取等质量的两种配合物晶体的样品配成待测溶液;
分别取等质量的两种配合物晶体的样品配成待测溶液;
![]() 分别往待测溶液中滴入
分别往待测溶液中滴入![]() 溶液,均产生白色沉淀;
溶液,均产生白色沉淀;
![]() 溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。试推断紫色晶体的化学式为_________。
。试推断紫色晶体的化学式为_________。
(5)含有元素K的盐的焰色反应为__________色。许多金属盐都可以发生焰色反应,其原因是____________。
(6)立方氮化硼晶体![]() ,是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
,是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
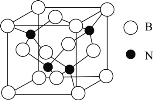
若立方氮化硼晶胞的边长为![]() ,则立方氮化硼的密度为________g/cm3
,则立方氮化硼的密度为________g/cm3![]() 只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L1·s1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
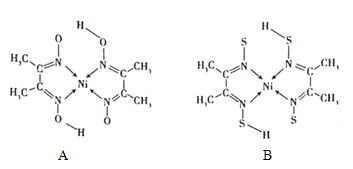
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
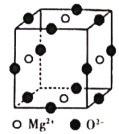
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) N2(g)+CO2(g)。向容积均为l L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
0min | 40min | 80min | 120min | 160min | ||
甲 | T℃ | 2mol | 1.45 mol | 1 mol | 1 mol | 1 mol |
乙 | 400℃ | 2 mol | 1.5 mol | 1.1 mol | 0.8 mol | 0.8 mol |
丙 | 400℃ | 1 mol | 0.8 mol | 0.65 mol | 0.53 mol | 0.45 mol |
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____________________;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,l mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
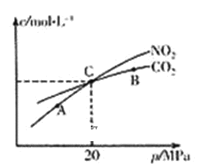
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com