
科目: 来源: 题型:
【题目】NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为_____。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为____。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
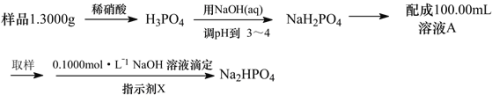
①NaOH标准溶液应盛放在如图所示的滴定管___(选填“甲”或“乙”)中。

②滴定时所用的指示剂X可为____,判断滴定终点的方法是___。
③下列操作会导致测定结果偏低的是____
A.碱式滴定管未润洗
B.锥形瓶用待测液润洗
C.读取标准液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
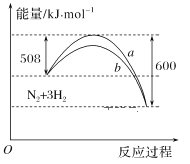
A.在温度、体积一定的条件下,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2molN2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1
B.该反应的热化学方程式为:N2+3H22NH3 ΔH=-92kJ·mol-1
C.a曲线是加入催化剂时的能量变化曲线
D.加入催化剂,该化学反应的反应热改变
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应mA(g)+nB(g)![]() pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
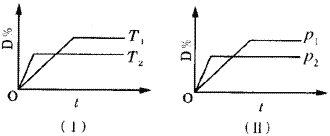
A.降温,化学平衡向正反应方向移动
B.使用催化剂可使D%有所增加
C.化学方程式中气体的化学计量数m+n>q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是( )
Z(g)+W(s) △H>0,下列叙述正确的是( )
A.该反应平衡常数的表达式为K=![]()
B.平衡后加入X,上述反应的△H增大
C.升高温度,平衡逆向移动
D.当容器中气体压强不变时,反应达到平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则:2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
B.将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
C.已知氢在氯气中燃烧的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-285.8kJ/mol,所以H2(g)的燃烧热是285.8kJ·mol-1,
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】研究物质结构是研制新型材料的基础。回答下列问題:
(1)基态钛原子的价电子排布图为______,其原子核外共有______种运动状态不相同的电子。金属钛晶胞堆积方式为六方最密堆积,配位数是______。
(2)①下列关于气态![]() 和
和![]() 的说法中,正确的是______
的说法中,正确的是______
A.中心原子的价层电子对数目相等![]() 都是极性分子
都是极性分子
C.中心原子的孤对电子数目相等![]() 都含有极性键
都含有极性键
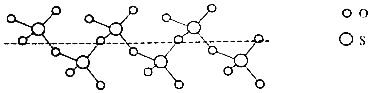
②将纯液态![]() 冷却凝固得到一种螺旋状单链结构的固体,其结构如下图,此固态
冷却凝固得到一种螺旋状单链结构的固体,其结构如下图,此固态![]() 中S原子的杂化轨道类型是______。
中S原子的杂化轨道类型是______。
(3)配合物![]() 熔点
熔点![]() ,沸点
,沸点![]() 不溶于水,易溶于乙醇、苯等有机溶剂。该晶体的类型为______,
不溶于水,易溶于乙醇、苯等有机溶剂。该晶体的类型为______,![]() 中不含有的作用力为______。
中不含有的作用力为______。
A.![]() 键
键 ![]() 键
键 ![]() 配位键
配位键 ![]() 非极性键
非极性键
(4)开发新型储氢材料是氢能利用的重要研究方向。
①![]() 与La
与La![]() 镧
镧![]() 的合金可做储氢材料,该晶体的晶胞如图所示,在晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为______。
的合金可做储氢材料,该晶体的晶胞如图所示,在晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为______。
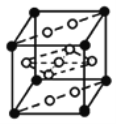
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______![]() 填标号
填标号![]() 。
。
A.![]()
![]()
![]()
![]()
(5)向硫酸铜溶液中加入过量氨水得到深蓝色溶液,原因是生成了一种配离子,不考虑空间结构,这种配离子的结构可用示意图表示为______![]() 配位键用
配位键用![]() 标出
标出![]() 。已知:
。已知:![]() 与
与![]() 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但![]() 不易与
不易与![]() 形成配离子,其原因是______。
形成配离子,其原因是______。
(6)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,晶胞边长为![]() ,若阿伏加德罗常数用
,若阿伏加德罗常数用![]() 表示,则立方氮化硼的密度是______
表示,则立方氮化硼的密度是______![]() 只要求列算式
只要求列算式![]()
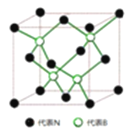 .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 5.0 | 3.5 | 2.5 | 2.5 |
下列说法正确的是
A. 500s内N2O5分解速率为6×10-3mol/(L·s)
B. 该温度下的平衡常数K =125
C. 反应达平衡时,吸收的热量为5Q kJ
D. 其他条件不变,若开始时c(N2O5)=10mol/L,则达平衡后c(N2O5)=5mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温常压下,N2(g)+3H2(g ) 2NH3(g) △H=-92.4 kJ /mol在同温同压下向一密闭容器中通入1molN2和3molH2,反应完后放出热量为Q1 kJ,向另一个体积相同的密闭容器通入2molNH3,相同条件下反应完成时吸收热量为Q2 kJ,且Q2=3Q1则下列说法正确的是( )
A.Q1=92.4 kJ B.Q1+Q2=92.4
C.H2的转化率为75%D.两个容器中NH3的百分含量不同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_______________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_______________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com