
【题目】NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为_____。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为____。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
①NaOH标准溶液应盛放在如图所示的滴定管___(选填“甲”或“乙”)中。

②滴定时所用的指示剂X可为____,判断滴定终点的方法是___。
③下列操作会导致测定结果偏低的是____
A.碱式滴定管未润洗
B.锥形瓶用待测液润洗
C.读取标准液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失
【答案】H2PO4-HPO42-+H+ HPO42-+H2OH2PO4-+OH- 乙 酚酞 滴入最后一滴NaOH溶液时,锥形瓶中溶液由无色变为红色,且半分钟内不变化 C
【解析】
(1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度;
(3)①碱性溶液用碱式滴定管量取;
②NaH2PO4溶液显弱碱性,应选用碱性范围内变色的酚酞作指示剂;根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
③根据c(待测)= 判断不当操作对相关物理量的影响;
判断不当操作对相关物理量的影响;
(1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度,该阴离子电离方程式为H2PO4-HPO42-+H+,
故答案为:H2PO4-HPO42-+H+;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度,该阴离子水解方程式为HPO42-+H2OH2PO4-+OH-,
故答案为:HPO42-+H2OH2PO4-+OH-;
(3)①NaOH标准溶液应盛放在如图所示的滴定管,
故答案为:乙;
②NaH2PO4溶液显弱酸性,应选用碱性范围内变色的酚酞作指示剂,滴定终点时颜色变化明显;用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:酚酞;滴入最后一滴NaOH溶液时,锥形瓶中溶液由无色变为红色,且半分钟内不变化;
③A. 碱式滴定管未润洗,标准液被稀释,造成V(标准)偏大,根据c(待测)= 分析,c(待测)偏大,故A错误;
分析,c(待测)偏大,故A错误;
B. 锥形瓶用待测液润洗,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)= 分析,c(待测)偏大,故B错误;
分析,c(待测)偏大,故B错误;
C. 读取标准液读数时,滴定前仰视,滴定到终点后俯视,造成V(标准)偏小,根据c(待测)= 分析,c(待测)偏小,故C正确;
分析,c(待测)偏小,故C正确;
D. 滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= 分析,c(待测)偏大,故D错误;
分析,c(待测)偏大,故D错误;
故答案选C。


科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某兴奋剂的结构简式如下图所示。下列有关说法正确的是 ( )
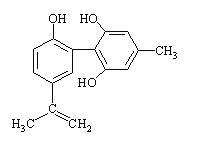
A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 滴入酸性KMnO4溶液,紫色褪去,即证明其结构中肯定存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为2 mol和7 mol
D. 该分子中的所有碳原子可以共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭的容器中加入N2(g)和H2(g),发生反应N2(g)+3H2(g)2NH3(g) △H<0在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( )

A.t0-t1B.t2-t3
C.t3-t4D.t5-t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质结构是研制新型材料的基础。回答下列问題:
(1)基态钛原子的价电子排布图为______,其原子核外共有______种运动状态不相同的电子。金属钛晶胞堆积方式为六方最密堆积,配位数是______。
(2)①下列关于气态![]() 和
和![]() 的说法中,正确的是______
的说法中,正确的是______
A.中心原子的价层电子对数目相等![]() 都是极性分子
都是极性分子
C.中心原子的孤对电子数目相等![]() 都含有极性键
都含有极性键
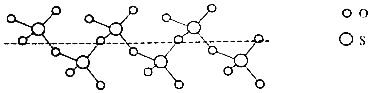
②将纯液态![]() 冷却凝固得到一种螺旋状单链结构的固体,其结构如下图,此固态
冷却凝固得到一种螺旋状单链结构的固体,其结构如下图,此固态![]() 中S原子的杂化轨道类型是______。
中S原子的杂化轨道类型是______。
(3)配合物![]() 熔点
熔点![]() ,沸点
,沸点![]() 不溶于水,易溶于乙醇、苯等有机溶剂。该晶体的类型为______,
不溶于水,易溶于乙醇、苯等有机溶剂。该晶体的类型为______,![]() 中不含有的作用力为______。
中不含有的作用力为______。
A.![]() 键
键 ![]() 键
键 ![]() 配位键
配位键 ![]() 非极性键
非极性键
(4)开发新型储氢材料是氢能利用的重要研究方向。
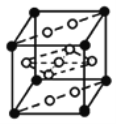
①![]() 与La
与La![]() 镧
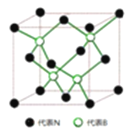
镧![]() 的合金可做储氢材料,该晶体的晶胞如图所示,在晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为______。
的合金可做储氢材料,该晶体的晶胞如图所示,在晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为______。
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______![]() 填标号
填标号![]() 。
。
A.![]()
![]()
![]()
![]()
(5)向硫酸铜溶液中加入过量氨水得到深蓝色溶液,原因是生成了一种配离子,不考虑空间结构,这种配离子的结构可用示意图表示为______![]() 配位键用
配位键用![]() 标出
标出![]() 。已知:
。已知:![]() 与
与![]() 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但![]() 不易与
不易与![]() 形成配离子,其原因是______。
形成配离子,其原因是______。
(6)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,晶胞边长为![]() ,若阿伏加德罗常数用
,若阿伏加德罗常数用![]() 表示,则立方氮化硼的密度是______
表示,则立方氮化硼的密度是______![]() 只要求列算式
只要求列算式![]()
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
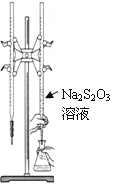
A. 该滴定可用甲基橙做指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定可选用右图所示装置
D. 该反应中每消耗2mol Na2S2O3,电子转移数为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的分子式为![]() ,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为
,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为![]() 和
和![]() ,已知
,已知![]() 分子的键角为
分子的键角为![]() 。下列推断不正确的是
。下列推断不正确的是 ![]()
![]()
A.![]() 分子的空间构型为V形
分子的空间构型为V形
B.![]() 键为极性共价键,
键为极性共价键,![]() 分子为非极性分子
分子为非极性分子
C.![]() 分子中A原子采取
分子中A原子采取![]() 杂化
杂化
D.![]() 分子中无H原子,分子间不能形成氢键
分子中无H原子,分子间不能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A. a点由水电离出的c(OH-)=1.0×10-14 mol·L-1
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)>c(NH4+)
D. d点:达到滴定终点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com