
【题目】在密闭的容器中加入N2(g)和H2(g),发生反应N2(g)+3H2(g)2NH3(g) △H<0在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( )

A.t0-t1B.t2-t3
C.t3-t4D.t5-t6
【答案】D
【解析】
可逆反应N2(g)+3H2(g)2NH3(g)△H<0,该反应为体积减小的放热反应,改变反应条件平衡移动,根据各时刻的速率变化判断平衡移动移动方向,据此判断NH3的含量变化,据此解答。
可逆反应N2(g)+3H2(g)2NH3(g) △H<0,该反应为体积减小的放热反应,
A.t0~t1,正、逆反应速率相等,平衡不移动,氨气的含量不变,故A不符合题意;
B.t2~t3,正、逆反应速率相等,处于平衡状态,氨气的含量不变,氨气含量较t1~t2低,故B不符合题意;
C.t3~t4,正、逆反应速率都同等程度的增大平衡不移动,氨气的含量不变,氨气含量与t2~t3相同,故C不符合题意;
D.t5~t6,正、逆反应速率相等,平衡不移动,氨气的含量不变,氨气含量较t4~t5低,故D符合题意;
所以平衡混合物中氨的百分含量最低的时间段是t5~t6
答案选D。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用![]() 表示,下列叙述正确的是
表示,下列叙述正确的是![]()
①![]() 含有电子数为
含有电子数为![]()
②![]() 中含有的
中含有的![]() 键总数目为
键总数目为![]()
③![]()
![]() 与
与![]() 完全反应时转移电子数为
完全反应时转移电子数为![]()
④![]() 硅晶体中含有
硅晶体中含有![]() 个
个![]() 键
键
⑤![]() 通入足量氢氧化钠溶液中充分反应,转移的电子数等于
通入足量氢氧化钠溶液中充分反应,转移的电子数等于![]()
⑥![]() ,
,![]()
![]() 溶液中,
溶液中,![]() 和
和![]() 离子数的总和是
离子数的总和是![]()
⑦在常温常压下,![]() 铁与
铁与![]()
![]() 充分反应,转移的电子数为
充分反应,转移的电子数为![]()
⑧![]() 和
和![]() 的混合物共
的混合物共![]() ,其中所含原子数一定为
,其中所含原子数一定为![]() .
.
A.①②③⑤⑧B.②④⑥⑦⑧C.①③⑤⑥⑦D.①②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn和Bi形成的晶体薄膜是一种金属间化合物![]() 晶胞结构如图
晶胞结构如图![]() ,有关说法正确的( )
,有关说法正确的( )
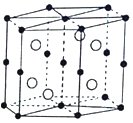
A.锰价电子排布为![]()
B.Bi是d区金属
C.该合金堆积方式是简单立方
D.该晶体的化学式为MnBi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填空。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
②同体积、同PH的三种酸,中和NaOH的能力由大到小的顺序是________。
③将PH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
(2)已知:Ksp(AgBr)=7.7×10-13,Ksp(AgSCN)=1×10-12;AgBr(s)+SCN-(aq)![]() AgSCN(s)+Br-(aq)的平衡常数____________。
AgSCN(s)+Br-(aq)的平衡常数____________。
(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序是________________(填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(4)在室温下,有下列四种溶液:①NH4Cl②CH3COONH4③NH4HSO4④NH3·H2O,若c(NH4+)相等,则四种溶液的浓度由大到小的排列顺序是__________(填序号)。
(5)某二元弱酸H2A,已知:Ka1=1.54×10-2,Ka2=1.02×10-7;NaHA溶液显________性,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温常压下,N2(g)+3H2(g ) 2NH3(g) △H=-92.4 kJ /mol在同温同压下向一密闭容器中通入1molN2和3molH2,反应完后放出热量为Q1 kJ,向另一个体积相同的密闭容器通入2molNH3,相同条件下反应完成时吸收热量为Q2 kJ,且Q2=3Q1则下列说法正确的是( )
A.Q1=92.4 kJ B.Q1+Q2=92.4
C.H2的转化率为75%D.两个容器中NH3的百分含量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10)。
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为_____。
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为____。
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
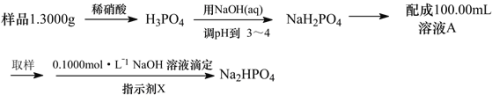
①NaOH标准溶液应盛放在如图所示的滴定管___(选填“甲”或“乙”)中。

②滴定时所用的指示剂X可为____,判断滴定终点的方法是___。
③下列操作会导致测定结果偏低的是____
A.碱式滴定管未润洗
B.锥形瓶用待测液润洗
C.读取标准液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.元素的第一电离能越大,其金属性越强
B.原子核外的 M层上的 s能级和 p能级都填满了电子,而 d轨道上尚未排有电子的两种原子,其对应元素不一定位于同一周期
C.元素电负性越大的原子,失电子能力越强
D.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
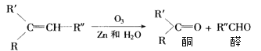
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种B. 4种C. 5种D. 6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com