
科目: 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】将A与B的混合物15mol放人容积为2L的密闭容器里,在一定条件下发生反应:2A(g)+3B(g)![]() C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1
C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.(1)用系统命名法命名![]() ___;
___;
(2)相对分子质量为114,其一氯代物只有一种的链烃的结构简式___;
(3)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为__。
Ⅱ.(1)将有机物B置于氧气流中充分燃烧,实验测得生成7.2gH2O和13.2gCO2,消耗氧气10.08L(标准状况),则该物质中各元素的原子个数之比是___。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为___,该物质的分子式是___。

(3)根据价键理论,预测A可能的结构简式:___(写出其中2种)。
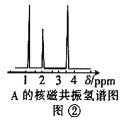
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值可以确定分子中氢原子的种类和数目。经测定,有机物A的核磁共振氢谱如图②,则A的结构简式为:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】I、烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:将vL气样通入适量酸化的H2O2溶液中,恰好使NOx完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO被H2O2氧化为NO3-的离子方程式为___。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;滴定操作使用的玻璃仪器主要有___。
(3)滴定过程中发生下列反应:3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O、Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NOx的物质的量为___mol。
(4)下列操作会使滴定结果偏高的是___
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4标准溶液部分变质
II、常温下,用酚酞作指示剂,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。

(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:___。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下发生反应:4NO2(g)+O2(g)![]() 2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
时间/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol·L-1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol·L-1) | 1.00 | c1 | c2 | 0.50 |
(1)0~10s内N2O5的平均反应速率为___,此温度下的平衡常数为___。
(2)其他条件不变,将容器体积压缩一半,则重新达到平衡时c(N2O5)___2.00mol·L-1(填“>、<或=”,下同)
(3)假设温度T1时平衡常数为K1,温度T2时平衡常数为K2,若K1<K2,则T1__T2。
(4)改变哪些措施可以增加NO2的平衡转化率___(答出任意两条即可)
(5)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ·mol1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=___kJ/mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】I. 用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
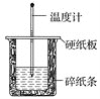
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。
(3)实验时所用盐酸及NaOH溶液的体积均为50 mL,各溶液密度均为1 g·mL-1,生成溶液的比热容c=4.18 J·g-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式ΔH=________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
II.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | VmL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为___________(用a、b 表示)。
(2)负极反应式为________。
(3)电极表面镀铂粉的原因为___________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是_____,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇可作为燃料电池的原料,以CH4和H2O为原料,通过下列反应来制备甲醇:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0kJmol-1
CO(g)+2H2(g)═CH3OH(g) △H=-129.0kJmol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______。
(2)甲醇对水质会造成一定污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:

①完成除去甲醇的离子方程式:______
Co3++CH3OH+H2O═Co2++……
②若如图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com